FYB201
Ranibizumab-Biosimilar
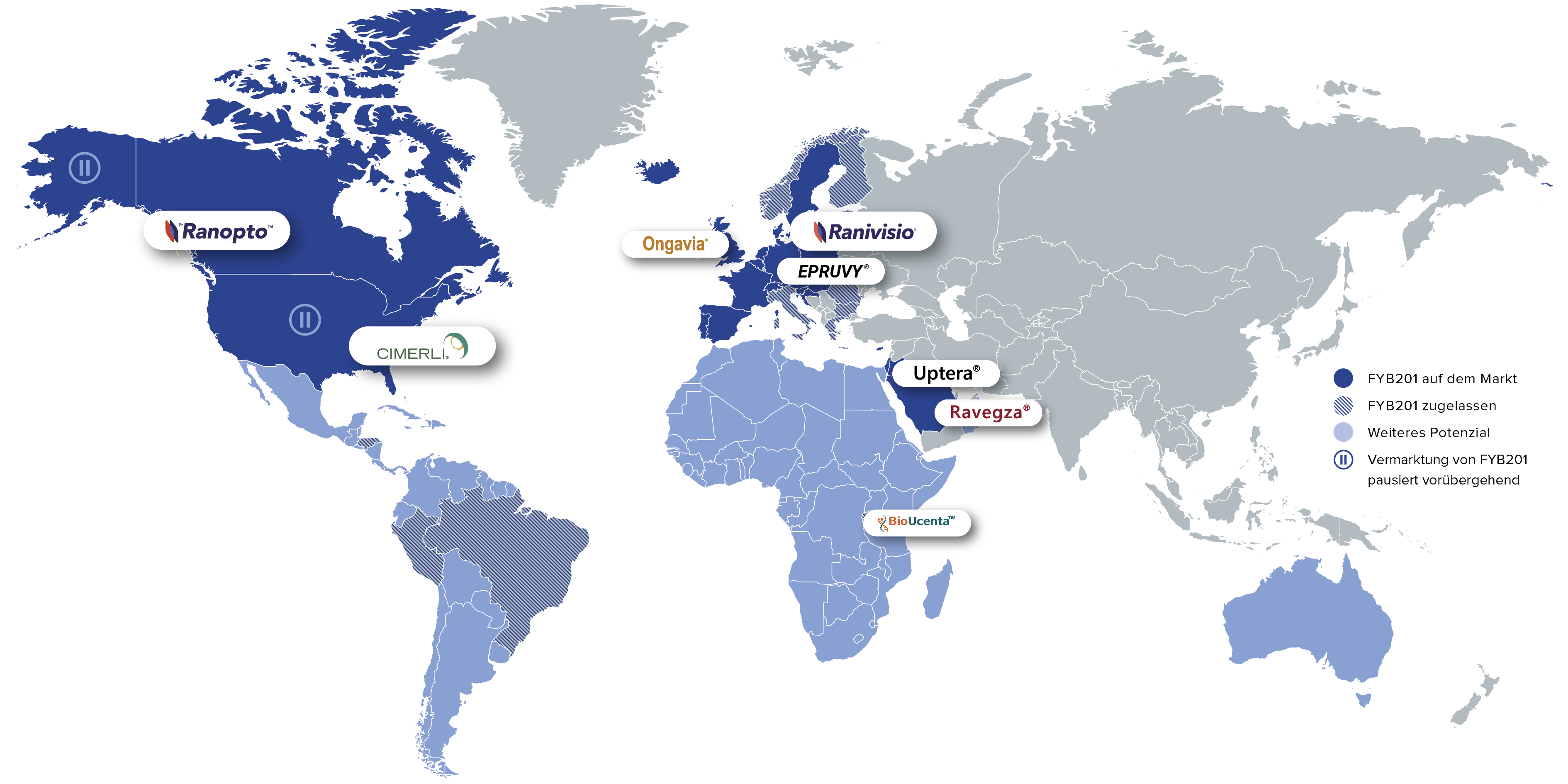
FYB201 ist als Behandlungsoption für Patientinnen und Patienten mit schweren Netzhauterkrankungen derzeit in 24 Ländern weltweit auf dem Markt. Weitere Produkteinführungen – unter anderem in Lateinamerika und auf dem afrikanischen Kontinent – sind geplant.
Indikationsgebiet
Ophthalmologie
Wirkstoffgruppe
VEGF-Inhibitoren
Indikationen des Referenzarzneimittels
Neovaskuläre (feuchte) altersbedingte Makuladegeneration, Diabetisches Makulaödem, Choroidalen Neovaskularisation, Proliferative diabetische Retinopathie, Makulaödem infolge eines Netzhautvenenverschlusses*
Markteintritt
seit 2022
Business-Modell:
50 % Formycon-Projekt über die Beteiligung an der Bioeq AG, einem Joint Venture der Formycon AG und der Polpharma Biologics Group B.V.
Ranibizumab-Markt
Ranibizumab gehört zu den am häufigsten eingesetzten Anti-VEGF-Medikamenten. Im Jahr 2024 verzeichnete das Referenzarzneimittel Lucentis® einen weltweiten
Umsatz von rund 1,0 Mrd. US$.
Kommerzialisierungspartner:
![]()
Brands: Ranivisio®, Ongavia®, Ranopto®
Region: EU, Großbritannien, Kanada
![]()
Brands: Cimerli®, Epruvy®
Region: US, Deutschland
![]()
Brands: Ravegza®, Uptera®
Region: MENA
![]()
Brands: BioUcenta
Region: Sub-Sahara Afrika
![]()
Brands: Ranivisio®
Region: Brasilien
sind in der Produktinformation der EMA oder FDA zu entnehmen.
FYB201 Biosimilar-Entwicklung
FYB201 Biosimilar-Entwicklung
So wirkt FYB201 (Ranibizumab)
FYB201/Ranibizumab ist ein monoklonaler Antikörper, der zur Behandlung von Erwachsenen mit Sehbeeinträchigungen aufgrund einer Schädigung der Netzhaut – insbesondere der Makula – verabreicht wird. Die Makula sorgt für das Sehvermögen, das für alltägliche Tätigkeiten wie Autofahren, Lesen und Erkennen von Gesichtern erforderlich ist.
Der Antikörper bindet an den vaskulären endothelialen Wachstumsfaktor A (VEGF-A), der das Wachstum von Blutgefäßen fördert und zum Austreten von Flüssigkeit und Blut führt. Das ist die Ursache für die Schädigung der Makula. Durch die Blockierung von VEGF-A reduziert Ranibizumab das Wachstum der Blutgefäße, sowie das Austreten von Flüssigkeit und die Schwellung.
Oktober 2025
![]()
Ranivisio® ist das erste Lucentis®-Biosimilar in Europa, das als Fertigspritze auf den Markt kommt.
[Weitere Informationen]
Juli 2025
![]()
Bio Usawa wird Vermarktungspartner für die Region Subsahara-Afrika
[Weitere Informationen]
Juni 2025
![]()
Zulassung in Brasilien
[Weitere Informationen]
April 2024
![]()
Produkteinführung in Kanada und der Schweiz
[Weitere Informationen]
März 2024
![]()
Zulassungen und Markteinführungen in der MENA-Region
[Weitere Informationen]
März 2024
![]()
Sandoz Inc. löst Coherus BioSciences als Kommerzialisierungspartner für die USA ab
Januar 2024
![]()
FYB201/CIMERLI® erreicht im Dezember 2023 einen Marktanteil
von 38 % in den USA
[Weitere Informationen]
Dezember 2023
![]()
Zulassung in Kanada
[Weitere Informationen]
Oktober 2023
![]()
FYB201/CIMERLI® erreicht 25 % Marktanteil in den USA
[Weitere Informationen]
August 2022
![]()
FYB201 erhält Zulassung durch die Europäische Kommission
[Weitere Informationen]
August 2022
![]()
FYB201 erhält US-Zulassung als austauschbares Biosimilar
[Weitere Informationen]
Juni 2022
![]()
FYB201 erhält CHMP-Empfehlung der EMA
[Weitere Informationen]
Mai 2022
![]()
Zulassung in Großbritannien
[Weitere Informationen]
Mai 2022
![]()
Transaktion mit der ATHOS KG zur Übernahme der Biosimilar-Assets FYB201 und FYB202
[Weitere Informationen]
Dezember 2021
![]()
MS Pharma wird Kommerzialisierungspartner für die MENA-Region
[Weitere Informationen]
Oktober 2021
![]()
Annahme des Zulassungsantrags durch die FDA
[Weitere Informationen]
August 2021
![]()
Formycon reicht Zulassungsantrag bei der FDA ein
[Weitere Informationen]
Juni 2021
![]()
Zulassungsantrag bei der EMA eingereicht
[Weitere Informationen]
Juni 2021
![]()
Teva Pharmaceutical Industries Ltd. wird Kommerzialisierungspartner für Europa, Kanada, Israel und Neuseeland
[Weitere Informationen]
November 2019
![]()
Coherus BioSciences Inc. wird Kommerzialisierungspartner für die USA
[Weitere Informationen]
Mai 2018
![]()
Erfolgreicher Abschluss der Phase-III-Studie
[Weitere Informationen]
Februar 2016
![]()
Start der klinischen Phase-III-Studie (First Patient-In)
[Weitere Informationen]
März 2015
![]()
Erfolgreiche GMP-Inspektion in Martinsried
[Weitere Informationen]
Ranivisio®ist eine eingetragene Marke von Bioeq AG · Ranopto™ ist eine Marke von Teva Canada Limited
Ravegza® und Uptera® sind eingetragene Marken von MS Pharma


