Biosimilars
In Qualität, Wirksamkeit und Sicherheit vergleichbar
Biosimilars sind eine junge, effektive und wettbewerbsfähige Arzneimittelklasse
Was sind Biosimilars?
Biosimilars sind zugelassene biopharmazeutische Arzneimittel, die hinsichtlich Qualität, Sicherheit und Wirksamkeit sehr ähnlich (bio-similar) zu einem biologischen Referenzprodukt sind. Sie werden in hoch regulierten Märkten wie der EU, den USA, Kanada, Japan und Australien nach strengen regulatorischen Verfahren zugelassen und nach dem Auslaufen der gesetzlichen Schutzfrist des Referenzproduktes auf den Markt gebracht.
Biosimilars sind ein schnell wachsendes und noch recht junges Segment in der pharmazeutischen Biotechnologie, analytischen Wissenschaft und klinischen Forschung. Ihre Entwicklung verlangt eine grundlegend andere Herangehensweise als bei den originalen Biopharmazeutika, wobei insbesondere das analytische Design eine wichtige Rolle spielt. Biosimilars werden auf der Basis neuester Technologien und unter Einhaltung hoher Qualitätsstandards hergestellt.
Vergleich Biosimilar (links) und Generikum (rechts):

BiosimilarsGroße komplexe Moleküle, die aus lebenden Zellen produziert werden
GenerikaMeist kleine synthetische Moleküle
Entwicklung und Produktion von Biosimilars
Die Entwicklung und Herstellung von Biosimilars ist aufgrund ihres komplexen Aufbaus und ihrer Herstellung in lebenden Zellsystemen aufwendig sowie zeitintensiv und verlangt eine große Expertise.
Das wichtigste Prinzip bei der Entwicklung eines Biosimilars ist die Vergleichbarkeit mit dem Referenzarzneimittel. Dabei müssen die Produzenten sicherstellen, dass die Qualität, Sicherheit und Wirksamkeit mit dem Referenzprodukt sehr ähnlich sind.
Im Durchschnitt liegt die Entwicklungsdauer eines Biosimilars bei sieben bis acht Jahren, wobei alle wesentlichen Schritte einer Arzneimittelentwicklung abgedeckt werden müssen. Aufgrund der anspruchsvollen Entwicklung und Produktion von Biosimilars gibt es weltweit nur wenige Unternehmen, die solche Medikamente für hochregulierte Märkte mit ihren strengen regulatorischen Anforderungen entwickeln und herstellen können.
Biosimilars durchlaufen in ihrer Entwicklung fünf Phasen:
Zulassung von Biosimilars
Grundsätzlich erfolgen die Zulassungen für Biosimilars durch die European Medicines Agency (EMA) und die U.S. Food and Drug Administration (FDA). Beide Behörden unterziehen Biosimilars einer strengen wissenschaftlichen Bewertung hinsichtlich Qualität, Sicherheit und Wirksamkeit, bevor sie durch die Europäische Kommission zur Vermarktung für den europäischen bzw. von der FDA für den US-amerikanischen Markt freigegeben werden. In Europa wurde das erste Biosimilar im Jahr 2006, in den USA im Jahr 2015 zugelassen.
Der Aufwand für eine Zulassung ist bei Biosimilars ungleich höher als bei herkömmlichen generischen Medikamenten. Um die Zulassung der Arzneimittelbehörden zu bekommen, müssen die Biosimilarhersteller nachweisen, dass ihr Produkt hinsichtlich Qualität, Sicherheit und Wirksamkeit sehr ähnlich zum Referenzprodukt ist. Dies wird durch intensive analytische Tests, klinische Studien und hochmoderne Fertigungsprozesse erreicht.
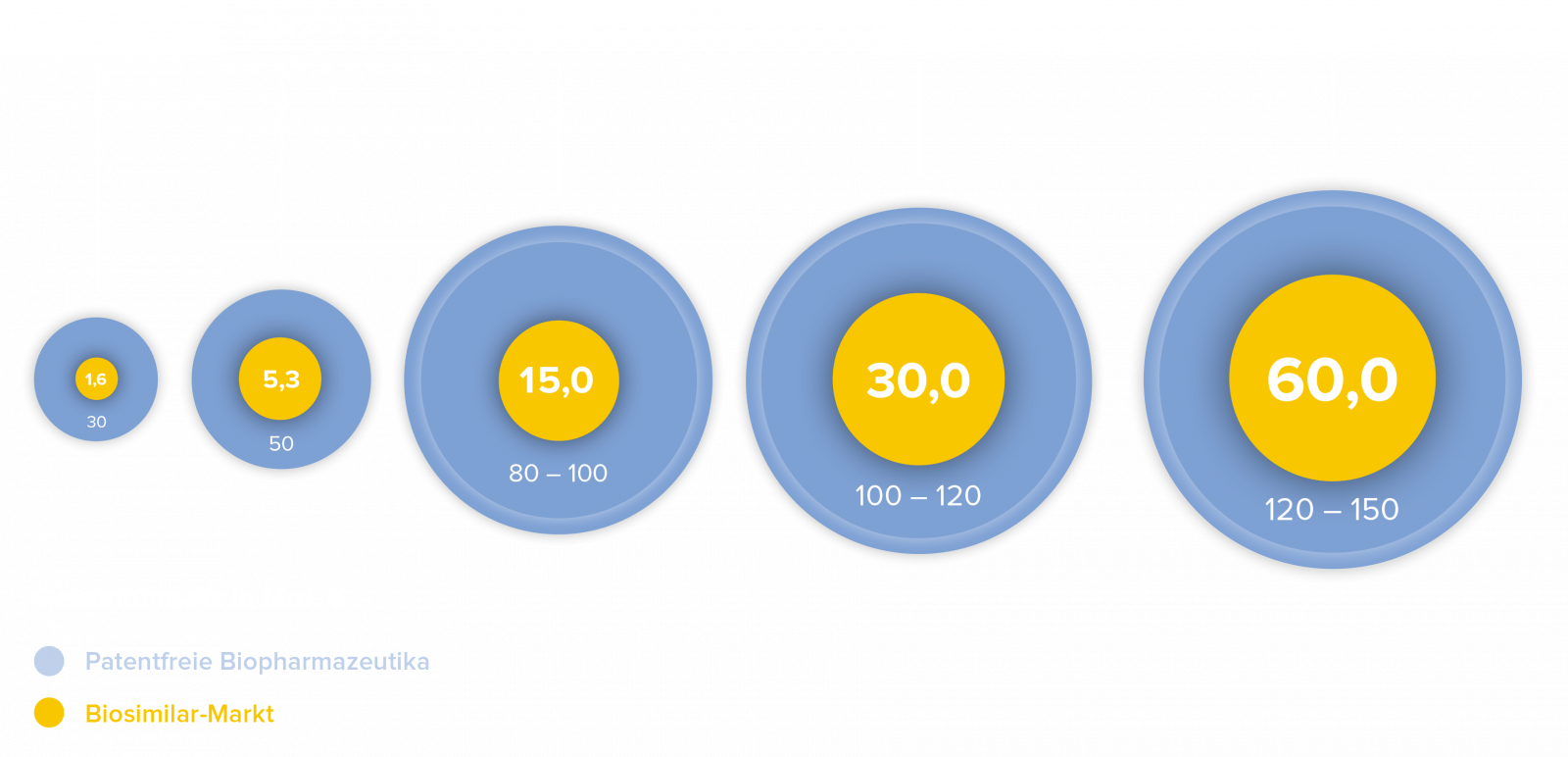
Der Markt für Biosimilars
Biosimilars sind das derzeit am schnellsten wachsende Segment des Pharmamarktes. Analysten schätzen, dass bis 2025 Biopharmazeutika mit einem Umsatz zwischen 100 und 120 Milliarden Dollar ihren Patentschutz verlieren werden. Der weltweite Umsatz mit Biosimilars, der derzeit rund 15 Milliarden Dollar beträgt, könnte nach Meinung von Branchenkennern bis 2025 auf rund 30 Milliarden Dollar und bis 2030 auf über 60 Milliarden Dollar ansteigen.
Da Biopharmazeutika bei der Behandlung ernster Erkrankungen zwar sehr effektiv, oftmals aber auch sehr teuer sind, stellen sie selbst für die Gesundheitssysteme reicher Industrieländer eine große finanzielle Belastung dar. Biosimilars sind für Ärzte, Apotheker und Patienten eine echte therapeutische Alternative und sorgen für Wettbewerb im Arzneimittelmarkt. Somit tragen sie zur finanziellen Entlastung der Gesundheitssysteme bei und verbessern die Verfügbarkeit hoch effektiver Arzneimittel für die Patienten.
Weitergehende Informationen finden Sie unter anderem im Handbuch Biosimilars der Arbeitsgemeinschaft Pro Biosimilars.