Formycon Aktie
Aktie
Mehrwert schaffen mit Biosimilars
Mit der Kommerzialisierung der nächsten Biosimilar-Assets und dem kontinuierlichen Ausbau der eigenen Entwicklungspipeline hat Formycon Wachstum und nachhaltige Profitabilität im Visier.
Aktien-
Chart

Basis-
Informationen
| Rechtsform | Aktiengesellschaft |
| Erstnotiz | 20. Dezember 2010 |
| ISIN | DE000A1EWVY8 |
| WKN | A1EWVY |
| Börsensegment | Regulierter Markt (Prime Standard) |
| Handelsplätze | Xetra, Berlin, Düsseldorf, Frankfurt, Hamburg, München, Stuttgart, Tradegate |
| Aktiengattung | Stückaktien o.N. |
| Grundkapital | 17.672.927,00 Euro |
| Anzahl der Aktien | 17.672.927 Stückaktien |
| Designated Sponsors | Oddo BHF Corporates |
Aktionärs-
Struktur
Stand: 11. November 2024
Diese Übersicht gibt die Stimmrechtsmitteilungen gemäß §§ 33ff Wertpapierhandelsgesetz (WpHG) wieder. Die einzelnen Mitteilungen finden Sie hier.
Analysten
Coverage
Analysten
Empfehlungen
| Broker | Empfehlung | Kursziel in € | Letztes Update |
|---|---|---|---|
| Berenberg | Kauf | 30,0 | 24.11.2025 |
| First Berlin | Kauf | 53,0 | 20.11.2025 |
| H.C. Wainwright | Kauf | 40,0 | 10.12.2025 |
| Kepler Cheuvreux | Kauf | 33,0 | 09.12.2025 |
| B. Metzler seel. Sohn & Co. | Kauf | 35,0 | 15.08.2025 |
| mwb [→ Research Formycon AG] | Kauf | 48,0 | 11.12.2025 |
| Oddo BHF | Neutral | 38,0 | 13.11.2025 |
| Royal Bank of Canada | Outperform | 51,0 | 17.11.2025 |
| Durchschnittliches Kursziel | 41,4 | 11.12.2025 |
Formycon wird von den oben genannten Analysten beobachtet und bewertet. Bitte beachten Sie, dass alle Meinungen, Schätzungen oder Prognosen dieser Analysten hinsichtlich der Entwicklung von Formycon allein deren Meinung, Schätzung oder Prognose widerspiegeln und nicht die von Formycon oder seinem Management. Der Verweis auf die Analysten bedeutet nicht, dass Formycon deren Meinungen bestätigt. Formycon ist darüber hinaus nicht verpflichtet, die oben angegebenen Informationen zu aktualisieren oder zu ergänzen und übernimmt keine Garantie für die Richtigkeit und Vollständigkeit dieser Liste.
Analysten Consensus
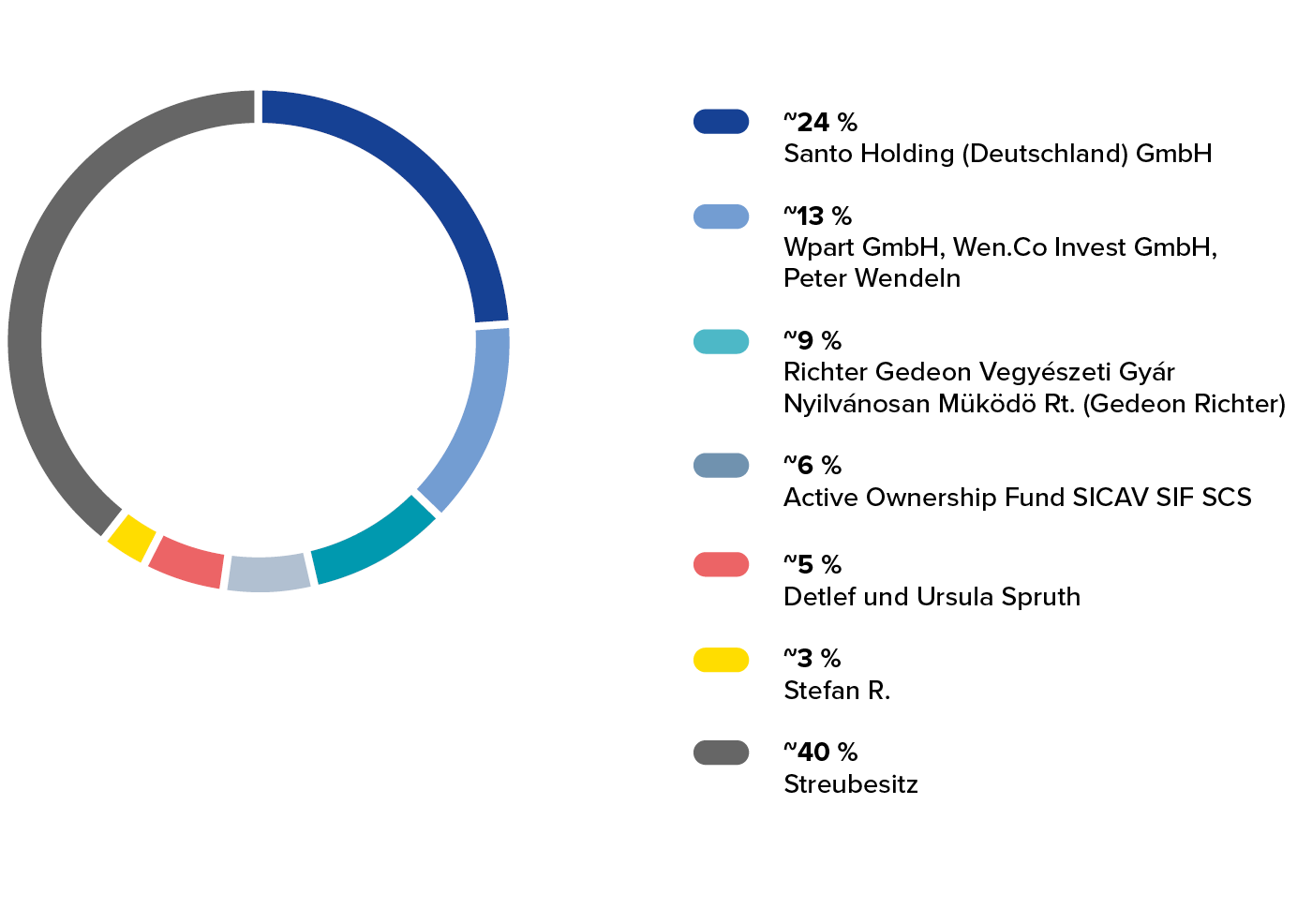
■ 24,05 % Santo Holding (Deutschland) GmbH, Thomas Peter Maier
■ 13,26 % Wpart GmbH, Wen.Co Invest GmbH, Peter Wendeln
■ 9,08 % Richter Gedeon Vegyészeti Gyár Nyilvánosan Müködö Rt. (Gedeon Richter)
■ 6,04 % Active Ownership Fund SICAV SIF SCS, Klaus Röhrig, Florian Schuhbauer
■ 5,10 % Detlef und Ursula Spruth
■ 3,28 % Stefan Reichensperger
■ 39,19 % Streubesitz
Blog
Blog
Formycon CFO Enno Spillner im Gespräch mit Andreas Schmidt von der SdK
17. Februar 2025
Im Gespräch mit Andreas Schmidt von der Schutzgemeinschaft der Kapitalanleger e.V. (SdK) erläutert Enno Spillner, warum Formycon auf die Phase-III-Studie für den Pembrolizumab Biosimilar-Kandidaten FYB206 verzichten kann. Darüber hinaus geht es um die aktuelle Dynamik auf dem US-Biosimilarmarkt, die zur Reduzierung der Umsatzerwartungen für das Ustekinumab-Biosimilar FYB202 und zur voraussichtlichen Pausierung der Vermarktung des Ranibizumab-Biosimilars FYB201 in den USA führt.
Sie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenUpdate zu Biosimilar-Projekten und zur US-Marktentwicklung
17. Februar 2025
Der Vorstand der Formycon AG hat die jüngsten Entwicklungen bei verschiedenen Biosimilar-Projekten im Rahmen eines Webcasts erörtert. Das Replay des Webcasts ist unter folgendem Link verfügbar: Formycon Update Februar 2025.
Kurzer Jahresrückblick 2024
06. Januar 2025
2024 war ein besonderes Jahr für Formycon. Mit einem kurzen Rückblick auf die operativen Highlights der letzten 12 Monate wünschen wir Ihnen einen guten Start in ein gesundes, glückliches, erfolgreiches und vor allem friedliches Jahr 2025.
mwb-research Roundtable
12. Dezember 2024
Im mwb-Research Roundtable blicken wir auf ein für Formycon ausgesprochen erfolgreiches Jahr zurück – auf die zahlreichen operativen Meilensteine ebenso wie auf die erfolgreiche Kapitalmarktstrategie, die uns im Dezember 2024 in den SDAX führt. Im Anschluss an eine kurze Präsentation geht der Vorstand der Formycon AG auf Zuschauerfragen ein.
Sie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenWachstum und Zukunft der Biotechnologie: Chancen durch Biosimilars
Gastbeitrag im Bio Deutschland Jahrbuch 2024/2025

Enno Spillner
Chief Financial Officer (CEO)
Formycon AG
Vor 20 Jahren war die Biotechnologie-Landschaft in Deutschland noch deutlich überschaubarer und BIO Deutschland begann als kleine Organisation mit relativ wenigen Mitgliedern aus der klassischen roten Biotechnologie. Wie die Branche, hat sich auch der Verband seitdem stark entwickelt und diversifiziert. Auch Formycon als Biosimilar-Spezialist gehört dazu und leistet seinen Beitrag zu Know-how, Investitionen und Wachstum.
Die Biotechnologie in Deutschland steht heute vor drei großen Herausforderungen: einem hohen Innovationsdruck, steigenden Kosten im Gesundheitssystem und unzureichender Finanzierung der Entwicklung. Es gab in den letzten Jahren bedeutende technologische Durchbrüche und viele der heute kommerziell international erfolgreichen Produkte basieren auf deutscher Innovationskraft und Technologie.
Fortschritt, Innovationskraft und verbesserte Gesundheitsversorgung führen aber auch zu steigenden Kosten im Gesundheitssystem. Eine logische Antwort darauf sind Biosimilars, die wir bei Formycon entwickeln. Diese biopharmazeutischen Nachfolgeprodukte ermöglichen es, hochwirksame Behandlungen zu deutlich niedrigeren Kosten anzubieten, was sowohl den Patienten als auch den Gesundheitssystemen zugutekommt. Die Bedeutung von Biosimilars wächst rasant und wird in den nächsten Jahren immer entscheidender, um den Zugang zu wirksamen Therapien zu verbessern und diese bezahlbar zu machen.
Die Entwicklung von Biosimilars ist komplex und erfordert jahrelange Forschung sowie hohe Investitionen bis zu ihrer Zulassung. Eine große technische und analytische Kompetenz sowie wissenschaftliche und regulatorische Expertise sind notwendig, um diesen Prozess erfolgreich zu meistern. Trotz der hohen Entwicklungskosten profitieren Biosimilar-Entwickler nicht von Exklusivitätsrechten, was den Margendruck erhöht. Deshalb müssen diese Unternehmen besonders effizient arbeiten, um im direkten Wettbewerb bestehen zu können. In einem Umfeld, in dem es keinen Patentschutz gibt, zählt jeder Tag und jeder Euro.
Der Erfolg eines Biosimilar-Unternehmens und insbesondere von Formycon basiert auf einem erfahrenen Entwickler-Team und einer klaren strategischen Planung bei der Auswahl der Kandidaten. Die enge Abstimmung zwischen Forschung, Entwicklung, Regulatorik und Vermarktung ist entscheidend, um ein Biosimilar erfolgreich auf den Markt bringen zu können. Bei Formycon haben wir gezeigt, wie wichtig es ist, auf die richtige Kombination aus Know-how und Erfahrung zu setzen. Unser Team hat sich in den letzten fünf Jahren auf rund 240 Mitarbeitende verdoppelt und wir haben all unsere geplanten Meilensteine erreicht: darunter die Zulassung und erfolgreiche Markteinführung unseres ersten Biosimilars in globalen Schlüsselmärkten sowie Zulassungen der FDA und EC für weitere Biosimilars in diesem Jahr.
Für Formycon ist die Auswahl der Partner – vor allem in den Bereichen Herstellung und Vermarktung – in diesem intensiven Wettbewerbsumfeld extrem wichtig, um Marktanteile und Margen zu sichern und den Markt mit hochqualitativen Biosimilars zu durchdringen. Die erfolgreiche Vermarktung und daraus resultierende Produktumsätze sichern in den nächsten Jahren einen Teil der Investitionen in unsere vielversprechende und diverse Pipeline von Biosimilars der nächsten Generation, wie z. B. für die dieses Jahr gestartete Entwicklung von Pembrolizumab.
Unser Erfolg basiert auf einer Mischung aus wissenschaftlicher Expertise, Marktintelligenz, Agilität, Flexibilität und Kostensensitivität, um im hart umkämpften Biosimilar-Markt zu wachsen und langfristig zu bestehen. Dies gilt auch für die deutsche Biotechnologie-Branche, die einem starken internationalen Wettbewerb ausgesetzt ist. Umso wichtiger ist die Arbeit von BIO Deutschland, die Interessen zu bündeln und sich für besser Rahmenbedingungen sowie Unterstützung in Politik und Öffentlichkeit einzusetzen. Biotech ist Zukunftstechnologie, die auch in den nächsten 20 Jahren Innovationen vorantreiben wird, um die Herausforderungen der Gesundheitssysteme zu meistern.
Opening Bell Ceremony an der Frankfurter Wertpapierbörse
05. Oktober 2024
Dr. Stefan Glombitza, CEO der Formycon AG und Enno Spillner, CFO der Formycon AG, sprechen bei der Opening Bell Ceremony über den für das Unternehmen so wichtigen Schritt, in den Prime Standard der Frankfurter Wertpapierbörse zu wechseln.
Biosimilars auf dem Vormarsch
05. Oktober 2024
Im Finanzpodcast des Effecten Spiegel spricht Formycon CFO Enno Spillner über Biosimilars, die Wachstumsaussichten des Marktes sowie die Strategie und die jüngsten Zulassungserfolge von Formycon.
Interview mit dem Vorstand
13. August 2024
Formycon ist ein Pure-Play Biosimilar-Unternehmen. Was ist darunter zuverstehen?

Dr. Stefan Glombitza
Chief Executive Officer (CEO)
Formycon AG
Dr. Stefan Glombitza, Chief Executive Officer: „Formycon ist ein global operierender, unabhängiger Spezialist für die Entwicklung von Biosimilars. Im Wachstumsmarkt der Biosimilars wollen wir führend werden und eine Position als Partner der Wahl für renommierte und vertriebsstarke Pharmaunternehmen einnehmen. Pure-Play bedeutet für uns: Volle Konzentration auf unsere Kompetenz und Exzellenz in allen Phasen der Entwicklung, vom Selektionsprozess eines Biosimilar-Kandidaten bis zur Zulassung.“
Was macht Sie so sicher, dass Biosimilars ein Wachstumsmarkt sind?
Stefan Glombitza: „Drei Gründe: Erstens das immense Marktvolumen der Biologika, die in den nächsten Jahren ihre Marktexklusivität verlieren, zweitens der große und weiter steigende medizinische Bedarf und drittens, die drückenden Finanzierungsprobleme der Gesundheitssysteme. Noch immer werden aus Kostengründen zu wenige Patientinnen und Patienten frühestmöglich mit hochwirksamen Biologika behandelt. Hier stellen Biosimilars mit ihrer vergleichbaren Wirksamkeit eine kosteneffiziente Lösung dar. Biosimilars schaffen finanzielle Freiräume, damit möglichst alle Patientinnen und Patienten frühzeitig die optimale Therapie erhalten können. Der medizinische Goldstandard darf nicht nur einigen wenigen vorbehalten bleiben.“
Haben Sie ein Beispiel für eine Erkrankung, in der der medizinische Bedarf nicht vollständig gedeckt wird, also faktisch eine Unterversorgung mit Biologika festzustellen ist?
Stefan Glombitza: „Ein Beispiel von vielen ist Morbus Crohn, eine chronisch-entzündliche Darmerkrankung. Selbst in einem Land wie Deutschland werden nach wie vor nur etwa 15 % der Morbus Crohn-Patienten mit hochwirksamen Biologika behandelt.1 Bei Morbus Crohn treten in den Akutphasen oft über mehrere Wochen heftige Entzündungssymptome auf. Das schränkt die Lebensqualität der Betroffenen massiv ein und bringt enorme psychische Belastungen mit sich. Die Therapieoption ist da, sie wird nur zu selten genutzt. Das wollen wir ändern – im konkreten Fall mit unserem Stelara®2 Biosimilar-Kandidaten FYB202, für den wir nach der positiven CHMP-Empfehlung3 schon bald mit der EU-Zulassung rechnen. Wenn Biosimilars wie unser FYB202 auf den Markt kommen, entsteht Wettbewerb, die Kosten sinken und die Versorgung wird besser.“
Die ersten sechs Monate des Jahres waren für Formycon geprägt von zahlreichen Entwicklungsfortschritten. Was waren für Sie die besonderen Highlights?
Stefan Glombitza: „Wir haben zu Beginn des Jahres gesagt: 2024 legen wir den Grundstein für die nächste Wachstumsphase, die uns mit den bis Anfang 2025 zugelassenen und vermarktungsfähigen Biosimilars mittelfristig zu nachhaltiger Profitabilität führen wird. Dabei sind wir auf einem sehr guten Weg.
Ein besonderes Highlight ist sicher die FDA4-Zulassung unseres Eylea®5-Biosimilars FYB203 für die USA. Mit FYB203, das ebenso wie FYB201 bei schwerwiegenden Netzhauterkrankungen wie der feuchten altersbedingten Makuladegeneration und verschiedenen Diabetes-Folgeerkrankungen eingesetzt werden kann, sind wir im Ophthalmologie-Sektor nun noch stärker aufgestellt.“
Wie steht es mit den weiteren Formycon-Entwicklungsprojekten?
Stefan Glombitza: „Wir sind sehr gut unterwegs und kommen zum Teil sogar schneller voran als erwartet. Bei unserem Keytruda®6 Biosimilar-Kandidaten FYB206 haben wir uns mit dem Start des klinischen Programms im Juni eine hervorragende Position verschafft. Das Projekt hat für uns große wirtschaftliche Bedeutung: Wir entwickeln ein Biosimilar für das weltweit umsatzstärkste Medikament. Da wird es auch in Zukunft eine enorme Nachfrage geben.
Für FYB202 rechnen wir mit der EU-Zulassung bereits Anfang des vierten Quartals 2024, also einige Wochen früher als ursprünglich geplant. Dies liegt nicht zuletzt an der hervorragenden Arbeit und den kurzen Reaktionszeiten unserer Entwicklungsteams. Die FDA-Zulassung für FYB202 wird ebenfalls für Ende September erwartet. Darüber hinaus wollen wir noch in der zweiten Jahreshälfte das neue Projekt FYB210 starten. Mit anderen Worten: wir erwarten in den nächsten Wochen und Monaten viele weitere positive Formycon-Nachrichten.“
Dr. Glombitza hat bereits die wirtschaftliche Bedeutung von FYB206 betont. Was sind die Besonderheiten in Bezug auf die klinische Entwicklung?
Dr. Andreas Seidl
Chief Scientific Officer (CSO)
Formycon AG

Dr. Andreas Seidl, Chief Scientific Officer: „Mit der Immun-Onkologie erschließen wir für uns ein Wirkstoffgebiet mit extrem hohem Potential. Nach aktuellen Schätzungen der IARC<sup>7</sup> nehmen Krebserkrankungen auch in Zukunft weltweit stark zu. Der Bedarf an modernen Therapien ist immens. Nicht ohne Grund wird eine große Zahl von Biosimilars für die Krebstherapie entwickelt.“
Wie kann FYB206 Krebspatienten helfen?
Andreas Seidl, Chief Scientific Officer: „Mit FYB206/Pembrolizumab entwickeln wir einen Biosimilar-Kandidaten, der das körpereigene Immunsystem aktiviert, um den Tumor zu bekämpfen. Das ist bei zahlreichen Krebsindikationen ein sehr aussichtsreicher Ansatz – zum Beispiel beim schwarzen Hautkrebs und beim nicht-kleinzelligen Lungenkrebs. Diese beiden
Indikationen sind es auch, in denen wir unsere klinischen Studien durchführen.“
Umsatzstarke Referenzarzneimittel bedeuten in der Regel auch zahlreiche Wettbewerber, wenn es um die Entwicklung eines Nachfolgepräparats geht. Wo sehen Sie Formycon in diesem Wettbewerb?
Andreas Seidl: „Der Start des klinischen Programms ist ein guter Indikator, um zu zeigen, wo wir beim Entwicklungsfortschritt im Vergleich zu unseren Mitbewerbern stehen. Unterm Strich können wir dabei sehr zufrieden sein, denn es zeigt sich, dass wir in der Führungsgruppe der Biosimilar-Entwickler mit den Zielmärkten USA und Europa dabei sind.“
Beide Studien laufen bereits?
Andreas Seidl: „Die beiden Studien laufen parallel und werden in mehreren Zentren in Osteuropa und Südostasien durchgeführt: Mitte Juni haben wir die Phase-I-Studie „Dahlia“ gestartet. Dabei vergleichen wir die Pharmakokinetik, Sicherheit und Verträglichkeit von FYB206 mit dem Referenzarzneimittel Keytruda®. Studienteilnehmer sind Patienten, bei denen ein malignes Melanom (schwarzer Hautkrebs) operativ entfernt wurde.
Für die Phase-III-Studie „Lotus“ haben wir Patienten mit nicht-kleinzelligem Lungenkrebs rekrutiert. Gestartet haben wir die Studie dann Ende Juli. In der Lotus-Studie wird die Sicherheit und Wirksamkeit von FYB206 und Keytruda® verglichen.“
Auch im Bereich der Vermarktung tut sich einiges. Wo liegen hier die aktuellen Schwerpunkte?

Nicola Mikulcik
Chief Business Officer (CBO)
Formycon AG
Nicola Mikulcik, Chief Business Officer: „Unser Lucentis®8-Biosimilar FYB201/Ranibizumab ist bereits in 19 Ländern weltweit verfügbar. In den USA und vielen anderen Märkten freuen wir uns über eine sehr gute Marktdurchdringung und führen das Feld der Ranibizumab-Biosimilars klar an. Und die Markteinführungen gehen ja weiter: Zuletzt konnten wir den Launch in Saudi-Arabien durch unseren Kommerzialisierungspartner MS Pharma bekannt geben. Weitere Zulassungen und Produkteinführungen sind bis in das Jahr 2026 geplant – regionale Schwerpunkte bilden dabei die Länder des Mittleren Ostens und Lateinamerikas.“
Wie entwickeln sich die Märkte in Europa?
Nicola Mikulcik: „Wir sind bestrebt, die Marktanteile auch in Europa weiter auszubauen. Eine zentrale Rolle wird dabei die Einführung einer Fertigspritze als Ergänzung zur aktuell verfügbaren Durchstechflasche (Vial) spielen. Diese Darreichungsform soll den behandelnden Ärzten im Verlauf des kommenden Jahres zur Verfügung stehen.“
FYB202 und FYB203 sind beide in einem marktnahen Stadium. Was sind die nächsten Schritte im Hinblick auf die Vermarktung?
Nicola Mikulcik: „Bei unserem Stelara® Biosimilar-Kandidaten FYB202 fokussieren wir uns gemeinsam mit unserem Vermarktungspartner Fresenius Kabi auf die Markteinführung und arbeiten daran, das Produkt zunächst in den USA und Europa in ausreichenden Mengen zur Verfügung zu stellen.
Für unser zweites Ophthalmologie-Produkt FYB203 hat der Lizenzinhaber Klinge Biopharma eine exklusive Lizenz- und Liefervereinbarung mit MS Pharma für die Vermarktung in der MENA-Region abgeschlossen. MS Pharma ist hier regional sehr gut aufgestellt und positioniert bereits unser FYB201 erfolgreich in den Märkten.
Für die USA und Europa erwarten wir den Abschluss von entsprechenden Vereinbarungen mit starken Kommerzialisierungspartnern in der zweiten Jahreshälfte.“
Wie stellt sich das Jahr 2024 bislang aus der Finanzperspektive dar?
Enno Spillner
Chief Financial Officer (CFO)
Formycon AG

Enno Spillner, Chief Financial Officer: „Der Einstieg von Gedeon Richter als strategischer Investor hat gleich zu Beginn des Jahres ein Ausrufezeichen gesetzt. Für uns ist das ein großer Erfolg und eine Bestätigung unseres Wachstumskurses und der hervorragenden Arbeit der vergangenen Jahre.
Der Mittelzufluss von ca. 83 Mio. € hat maßgeblich dazu beigetragen, dass wir unsere Biosimilar-Kandidaten – allen voran FYB206 – mit gleichbleibend hohem Entwicklungstempo und höchster Qualität weiterentwickeln können.“
Für zwei Biosimilars ist die Entwicklung so gut wie abgeschlossen. Welche Erwartungen knüpfen Sie an FYB202 und FYB203?
Enno Spillner, Chief Financial Officer: „Aktuell liegen wir mit allen unseren Projekten voll im Plan und blicken erwartungsvoll auf den Launch unseres Stelara® Biosimilar-Kandidaten FYB202 im Jahr 2025. Denn FYB202 wird nach globaler Markteinführung durch unseren Kommerzialisierungspartner Fresenius Kabi den Formycon-Umsatz deutlich steigern und mittelfristig zu einer nachhaltigen EBITDA-Profitabilität beitragen. Die Weichen sind durch die Settlement-Vereinbarungen mit Johnson & Johnson für den US-Markt, aber auch für die Märkte Europas und Kanadas gestellt.
Für FYB203 können wir das Launch-Datum aktuell noch nicht konkret benennen, da bislang noch keine Übereinkunft mit Regeneron, dem Hersteller des Referenzarzneimittels vorliegt.“
Sie haben die Prognose für das Geschäftsjahr 2024 gerade nach oben korrigiert. Das ist ein sehr positives Signal. Was waren die Auslöser?
Enno Spillner: „Unsere aktuellen operativen 2024’er Zahlen entwickeln sich gut bzw. sind voll im Plan. Umsätze und EBITDA werden weiter im prognostizierten Bereich erwartet. Unser Adjusted EBITDA konnten wir erfreulicherweise spürbar nach oben anpassen, da die Performance von FYB201 über unser Beteiligungsergebnis an dem Joint Venture Bioeq AG besser als erwartet und nachhaltig zu unserem Unternehmenserfolg beiträgt.“
Zusammenfassend kann man also von einem sehr erfolgreichen ersten Halbjahr 2024 sprechen. Und auch der weitere Weg ist klar vorgezeichnet?
Stefan Glombitza: „Unser Weg hin zu einem global führenden, unabhängigen Pure-Play Biosimilar-Unternehmen wird vom gesamten #TeamFormycon engagiert mitgetragen. Gleiches gilt für unseren Aufsichtsrat mit seiner großen internationalen Branchenerfahrung.
In diesem Zusammenhang möchte ich mich noch einmal herzlich bei den beiden im Juni ausgeschiedenen Aufsichtsratsmitgliedern Dr. Olaf Stiller und Peter Wendeln bedanken, die uns eine lange und sehr erfolgreiche Wegstrecke begleitet haben. Mit Wolfgang Essler und Klaus Röhrig sowie den neu gewählten Mitgliedern Dr. Bodo Coldewey, Nick Haggar und – ab Oktober 2024 – Colin Bond wollen wir diesen erfolgreichen Kurs in einem etwas internationaleren Setup fortsetzen.
Im Namen des Vorstands möchte ich mich ganz besonders bei unseren Mitarbeitenden bedanken. Ohne das außerordentliche Engagement des gesamten Teams wären die vielen bemerkenswerten Erfolge im ersten Halbjahr 2024 nicht möglich
gewesen. Herzlichen Dank auch unseren Aktionärinnen und Aktionären für das Vertrauen in uns und unsere Arbeit.“
Herzlichen Dank für das Gespräch!
- Baumgart, Misery, Naeyaert, Taylor: Biological Therapies in Immune-Mediated Inflammatory Diseases: Can Biosimilars Reduce Access Inequities?
- Stelara® ist eine eingetragene Marke von Johnson & Johnson
- Die Empfehlung des Ausschusses für Humanarzneimittel (CHMP) der EMA ist die Basis für die Zulassungsentscheidung der Europäischen Kommission
- US-amerikanische Zulassungsbehörde – U.S. Food and Drug Administration
- Eylea® ist eine eingetragene Marke von Regeneron Pharmaceuticals Inc.
- Keytruda® ist eine eingetragene Marke von Merck Sharp & Dohme LLC., einer Tochtergesellschaft von Merck & Co., Inc.
- IARC – Internationale Agentur für Krebsforschung
- Lucentis® ist eine eingetragene Marke von Genentech Inc.
Karriere__N4
Ihre Bewerbung
Gut zu wissen
Sie überlegen, Teil von #TeamFormycon zu werden? Hier finden Sie Antworten auf häufige Fragen rund um Bewerbung, Einstieg und Arbeiten bei Formycon.

Bewerbungsprozess und Ablauf
Bitte nutzen Sie für Ihre Bewerbung unsere Karriereseite, damit sie direkt das richtige Team erreicht. Um Sie und Ihre Stärken besser kennenzulernen, füllen Sie bitte das Bewerbungsformular vollständig und sorgfältig aus. Ein persönliches Anschreiben hilft uns, mehr über Ihre Motivation zu erfahren. Denken Sie bitte daran, alle wichtigen Unterlagen wie Lebenslauf und Zeugnisse beizufügen. Folgende Dateiformate (bis 15 MB) sind möglich: PDF, Word, Open Office, HTML, RTF, JPG, PNG, GIF und Textdateien. Wir freuen uns auf Ihre Bewerbung!
Ja, selbstverständlich können Sie sich auf mehrere Positionen gleichzeitig bewerben. Bitte reichen Sie für jede Stelle eine eigene, vollständige Bewerbung ein – so können wir Ihre Unterlagen gezielt der jeweiligen Position zuordnen und eine zügige Bearbeitung sicherstellen.
Sie können dabei gerne dieselben Dokumente verwenden. Überlegen Sie jedoch im Vorfeld, welche Positionen wirklich zu Ihnen und Ihren beruflichen Zielen passen.
Sollten Sie mehrere Bewerbungen einreichen, kann es im Gespräch vorkommen, dass wir nach Ihren Präferenzen fragen – einfach, um gemeinsam herauszufinden, wo Sie sich am besten entfalten können.
Unser Bewerbungsprozess umfasst in der Regel zwei Gesprächsrunden. Das erste Kennenlernen findet bequem per Videocall statt. Wenn wir das Gefühl haben, dass wir gut zueinander passen, laden wir Sie herzlich zu einem zweiten Gespräch an unseren Standort in Martinsried ein – denn der persönliche Austausch ist uns besonders wichtig.
Die Terminabstimmung und alle weiteren Informationen erhalten Sie direkt von unserem Recruiting-Team. Bitte beachten Sie, dass offizielle Einladungen ausschließlich über unsere E-Mail-Domain versendet werden. Sollten Sie eine Einladung von einem anderen Absender erhalten, melden Sie sich gerne bei uns zur Klärung.
Damit Ihre Bewerbung schnell und sicher bei uns ankommt, bitten wir Sie, sich ausschließlich über unsere Karriereseite zu bewerben. Von Bewerbungen per Post oder E-Mail bitten wir abzusehen – so können wir einen reibungslosen Ablauf für alle Bewerbenden gewährleisten.
In der Regel reicht es vollkommen aus, wenn Sie Ihre Bewerbung über unser System einreichen. Wir erwarten nicht, dass Sie zusätzlich die Personalabteilung oder die einstellende Führungskraft kontaktieren, um Ihr Interesse zu bekunden. Sollten Sie jedoch aus organisatorischen Gründen, wie beispielsweise der Terminverschiebung für ein Vorstellungsgespräch, Kontakt aufnehmen wollen, können Sie dies selbstverständlich jederzeit tun.
Wir bemühen uns, Ihre Bewerbung so schnell wie möglich zu bearbeiten, da wir wissen, wie wichtig eine zeitnahe Rückmeldung ist. Der genaue Ablauf und die Dauer des Prozesses können jedoch je nach Position und den jeweiligen internen Abläufen variieren.
Eine nachträgliche Änderung über das System ist leider nicht möglich. Sollten jedoch grobe Fehler in Ihrer Bewerbung vorliegen oder möchten Sie etwas ergänzen, antworten Sie einfach auf die Eingangsbestätigung Ihrer Bewerbung. Wir helfen Ihnen gerne weiter und finden eine Lösung!
Für Ihre Bewerbung benötigen wir mindestens einen aussagekräftigen Lebenslauf. Gern können Sie diesen um Zeugnisse oder Zertifikate ergänzen – so bekommen wir ein vollständiges Bild Ihrer Qualifikationen. Auch ein kurzes Motivationsschreiben ist willkommen, vor allem, wenn Sie uns noch mehr über sich erzählen möchten, als der Lebenslauf verrät. Wir freuen uns darauf, mehr über Sie zu erfahren!
Karriere und Einstieg
Selbstverständlich können Sie sich auch jederzeit initiativ bei uns bewerben. Wir freuen uns immer über engagierte Bewerbungen, auch wenn aktuell keine passende Stelle ausgeschrieben ist. Bitte nutzen Sie hierfür einfach unser Online-Bewerbungssystem [Link]. Dort können Sie Ihre Unterlagen einreichen und uns mitteilen, in welchem Bereich Sie sich eine Mitarbeit bei uns vorstellen können. Wir prüfen Ihre Bewerbung und melden uns, sobald eine passende Gelegenheit entsteht.
In der Regel suchen wir nach Bewerberinnen und Bewerbern mit sehr spezialisierten Fachkenntnissen, da unsere Positionen oft spezifische Anforderungen haben. In Einzelfällen kann auch ein Quereinstieg möglich sein, wenn Ihre Erfahrungen und Fähigkeiten gut zu der Position passen.
Ja, Formycon bietet engagierten Studierenden die Möglichkeit, praktische Erfahrungen in einem innovativen Umfeld zu sammeln – etwa im Rahmen von Praktika, Werkstudierendenstellen oder Abschlussarbeiten. Diese Positionen sind jedoch nur in begrenzter Anzahl verfügbar und werden auf unserer Karriereseite ausgeschrieben. Sollte dort aktuell keine passende Stelle zu finden sein, freuen wir uns über eine Initiativbewerbung und prüfen gerne individuell, ob ein Einsatz möglich ist.
Karriere beginnt nicht erst mit der Führungsposition – sie beginnt mit dem ersten Schritt. Egal, wo Sie heute stehen: Bei Formycon finden Sie vielfältige Möglichkeiten, sich beruflich und persönlich weiterzuentwickeln. Ob klassische Führungslaufbahn oder spezialisierte Fachkarriere, z. B. in der Forschung & Entwicklung – in beiden Fällen gilt: Wir begleiten Sie auf Ihrem Weg und schaffen den Rahmen, in dem Sie Ihre Stärken entfalten können.
Arbeiten bei Formycon
Aktuell bieten wir leider keine Möglichkeiten, aus dem Ausland für Formycon zu arbeiten.
Bei Formycon bieten wir eine hohe Flexibilität, was das Arbeiten von verschiedenen Orten angeht. Während wir kein reines Homeoffice-Modell anbieten, haben unsere Mitarbeitenden die Freiheit, selbst zu entscheiden, wo sie am produktivsten sind. Sie können in unseren Büroräumen in Martinsried, Ihrem eigenen Zuhause, aber auch flexibel innerhalb Deutschlands arbeiten. Mobiles Arbeiten ist in vielen Bereichen eine großartige Option – lediglich in spezialisierten Bereichen, wie zum Beispiel dem Labor, ist dies nur eingeschränkt möglich.
Der Arbeitsalltag bei Formycon hängt stark davon ab, in welchem Bereich Sie tätig sind. Eine pauschale Antwort gibt es daher nicht. Wenn Sie jedoch einen guten Eindruck von den verschiedenen Arbeitswelten bei uns bekommen möchten, werfen Sie gerne einen Blick auf die Erfahrungsberichte unserer Mitarbeitenden. Dort teilen Kolleginnen und Kollegen aus unterschiedlichen Bereichen ihre Einblicke – take a look [Link]!
Bei uns arbeiten Sie eigenverantwortlich und haben die Flexibilität, Ihre Arbeitszeit nach Ihren Bedürfnissen zu gestalten. Die reguläre Arbeitszeit in Vollzeit beträgt bei Formycon 40 Stunden pro Woche. Grundlage ist ein Jahresarbeitszeitkonto, das Ihnen zusätzliche Flexibilität in der Gestaltung Ihres Arbeitsalltags ermöglicht.
Auch wenn wir keine Kantine haben, bieten wir Ihnen den „Foodji“ – einen praktischen Essensautomaten, der eine bunte Auswahl an warmen Mahlzeiten, Snacks und Getränke bereithält. So können Sie sich jederzeit schnell und unkompliziert während des Arbeitstags stärken. Darüber hinaus gibt es für unsere Mitarbeitenden kostenfrei Wasser und Kaffee. In der näheren Umgebung finden Sie zudem ein vielfältiges und leckeres Essensangebot, sodass Sie ganz nach Lust und Laune auswählen können.
Ja, bei uns wird nicht nur das Mittagessen, sondern auch das Frühstück, Getränke und Snacks im „Foodji“ bezuschusst. So können Sie sich während des Arbeitstags ganz unkompliziert und zu attraktiven Preisen stärken.
Technische und organisatorische Fragen
Wenn Sie uns eine Bewerbung über unsere Webseite zukommen lassen, verarbeiten wir Ihre damit verbundenen personenbezogenen Daten entsprechend den Vorschriften des Bundesdatenschutzgesetzes. Details dazu, sowie unsere aktuellen Datenschutzbestimmungen finden Sie hier: [Link]. Formycon löscht nach Abschluss des Bewerbungsverfahrens automatisch alle personenbezogenen Daten. Die entsprechenden Löschfristen richten sich nach den gesetzlichen Bestimmungen des Landes.
Bei Fragen steht Ihnen unser Recruiting-Team von Formycon jederzeit gerne zur Verfügung. Sie erreichen uns einfach und unkompliziert per E-Mail.
Die Formycon AG hat ihren Sitz in Martinsried-Planegg, im südwestlichen Teil von München, eingebettet im bedeutenden Biotech-Cluster von Oberbayern. Eine detaillierte Anfahrtsbeschreibung finden Sie hier, um Ihre Anreise zu uns so einfach wie möglich zu gestalten.
Wir erstatten gerne die Fahrtkosten in Höhe eines 2. Klasse-Tickets der Deutschen Bahn für Hin- und Rückfahrt. Leider können wir Hotelkosten sowie Fahrtkosten innerhalb des Münchener Einzugsgebiets (Umkreis 30 km) nicht übernehmen. Wir hoffen jedoch, dass Ihre Anreise zu uns angenehm verläuft und stehen für weitere Fragen jederzeit zur Verfügung.
Für externe Partner
Wir bei Formycon arbeiten bereits mit einem bestehenden Netzwerk aus Personalvermittlungsagenturen zusammen. Wenn Sie uns passende Profile vorstellen möchten, können Sie dies ganz einfach über unser Online-Stellenportal auf der Formycon-Website tun. Klicken Sie einfach bei dem Stellenangebot auf „Bewerben“, setzen ein Häkchen im Kästchen „Für Personalberatung“ und geben die Agenturdetails ein. Anschließend können Sie die Unterlagen des Bewerbenden hochladen und mit „Senden“ an uns übermitteln. Falls das Kästchen nicht vorhanden ist, ist die Stelle nicht für Agenturen freigegeben. Bitte beachten Sie, dass wir Vermittlungsvorschläge von Personalvermittlern, die nicht über unser Online-Portal und ohne vorherige Absprache eingereicht werden, leider nicht berücksichtigen können.
Falls Sie Interesse an einer Zusammenarbeit haben, setzen Sie sich gerne mit unserem Recruiting-Team in Verbindung. Unsere Allgemeinen Geschäftsbedingungen für Personalberater, mit denen kein gültiger Vermittlungsvertrag besteht, finden Sie hier. Mit dem Hochladen eines Kandidatenprofils erklären Sie, diese zu akzeptieren.
Noch etwas unklar?
Dann melden Sie sich gerne
direkt bei unserem Recruiting-Team –
wir sind für Sie da.
Karriere__N3
Benefits
Ihre Arbeit ist wertvoll!
Unsere Benefits sind ein Zeichen
unserer Wertschätzung.

Engagierte und motivierte Mitarbeitende
sind der Schlüssel zu unserem Erfolg. Deshalb liegt uns Ihr
Wohlbefinden und Ihre Gesundheit besonders am Herzen.
Neben einer attraktiven Vergütung, 30 Tagen Urlaub und der Möglichkeit zum hybriden Arbeiten freuen wir uns vor allem auf das, was darüber hinausgeht: Wir unterstützen Sie aktiv bei Ihrer persönlichen und fachlichen Weiterentwicklung, fördern Ihre Gesundheit und bieten Ihnen mit der Formycon-Card ein echtes Extra. Wir möchten, dass Sie sich bei uns wohlfühlen und sich kontinuierlich weiterentwickeln können – gemeinsam gestalten wir eine erfolgreiche Zukunft!
Klicken Sie sich durch unsere Benefits und entdecken Sie,
was wir alles für Sie bereit halten:
Weiterkommen? Gestalten wir gemeinsam.
Entdecken Sie Ihre Potenziale und wachsen Sie täglich über sich hinaus! Ob Seminar, Kongress oder Vortrag – wir fördern Ihre fachliche und persönliche Entwicklung gezielt und praxisnah. Ihre Interessen und Stärken stehen dabei im Mittelpunkt. Mit neuem Wissen und frischen Impulsen bringen Sie innovative Ideen direkt in spannende Projekte ein und gestalten aktiv Ihre Zukunft.
Energiegeladene Pausen
Ob Kaffee, Tee, frisches Obst oder gesunde Snacks – bei Formycon ist für Ihr Wohl gesorgt. Unsere subventionierten Pausenangebote laden zum Auftanken ein: Der moderne Foodji-Automat bietet neben Snacks auch abwechslungsreiche Mittagessen – frisch, gesund und direkt vor Ort. So bleiben Sie konzentriert, fit und voller Energie – den ganzen Tag über.
Gesund bleiben – bei Formycon ein Benefit
Mit unserem umfassenden Gesundheitsangebot unterstützen wir Ihr Wohlbefinden und unterstützen Sie dabei, gesund zu bleiben. Unser Betriebsarzt kümmert sich direkt vor Ort um Impfungen und Check-ups. Außerdem profitieren Sie von Rabatten für Fitnessstudios und haben Zugang zu einer Plattform für mentale Gesundheit, inklusive psychologischer Online-Beratung.
Die Formycon-Card
Zusätzlich zu Ihrem Gehalt laden wir monatlich Ihre Formycon Prepaid-Kreditkarte auf. Ausgestattet mit unserem Logo, ist die Karte in der Region München weit verbreitet und bietet Ihnen ein praktisches Zahlungsmittel für den Alltag. Nutzen Sie die Karte ganz flexibel – weitere Informationen, wo Sie sie einsetzen können, finden Sie hier:
Flexibel arbeiten – gemeinsam erfolgreich
Hybrides Arbeiten verbindet das Beste aus beiden Welten: konzentriertes Arbeiten von zu Hause und kreativer Austausch im Büro. So bleiben wir flexibel, effizient und im engen Kontakt miteinander.
Work-Life-Balance, die passt!
Engagement im Arbeitsalltag braucht Raum zur Erholung: 30 Tage Urlaub, flexible Planung, Freizeitausgleich und freie Tage an Weihnachten und Silvester – bei uns lässt sich Arbeit gut mit Auszeit verbinden.
Sicher in die Zukunft – heute und morgen
Bei Formycon unterstützen wir Ihre Altersvorsorge großzügig – mit bis zu 50% des Entgeltumwandlungsbetrags, statt der gesetzlich vorgeschriebenen 15%. Darüber hinaus bieten Ihnen auf Wunsch eine persönliche, unabhängige Beratung.
Willkommen, von Anfang an
Bei uns starten Sie nicht einfach – Sie kommen an. Unser strukturierter Onboarding-Prozess begleitet Sie über sechs Monate hinweg mit festen Meilensteinen und regelmäßigen Feedbackgesprächen. Ein persönlicher Mentor aus Ihrem Fachbereich steht Ihnen dabei von Beginn an zur Seite. So finden Sie sich schnell zurecht – fachlich wie menschlich.
Globales Team, gemeinsame Mission
Bei Formycon arbeiten Sie in einem vielfältigen, internationalen Team, das durch Offenheit, Vernetzung und zahlreiche Perspektiven geprägt ist. Unsere Mitarbeitenden kommen aus vielen verschiedenen Ländern, was uns eine einzigartige, multikulturelle Arbeitsumgebung bietet.
Sicherheit geht vor
Ob Sommerfeste, Weihnachtsfeiern, Jubiläumsfeiern, Teamevents oder Dachterrassen-Partys – bei uns gibt es das ganze Jahr etwas zu feiern. Dabei sind Ihre Ideen für gemeinsame Erlebnisse im Team immer willkommen!
Für den Notfall gewappnet
Wir bieten unseren Formycon-Mitarbeitenden einen praxisnahen Erste-Hilfe-Kurs an – direkt vor Ort. So sind Sie im Ernstfall bestens vorbereitet und können schnell und richtig handeln.
Mehr als nur Weihnachten feiern
Ob Sommerfeste, Weihnachtsfeiern, Jubiläumsfeiern, Teamevents oder Dachterrassen-Partys – bei uns gibt es das ganze Jahr etwas zu feiern. Dabei sind Ihre Ideen für gemeinsame Erlebnisse im Team immer willkommen!
So stellen Sie sich
Ihren Arbeitgeber vor?
Dann sind Sie bei Formycon genau richtig. Wir bieten Ihnen ein wertschätzendes Umfeld, echte Benefits und die Chance, Ihr Potenzial voll zu entfalten. Wir freuen uns darauf, Sie kennenzulernen!
Karriere__N2
Arbeiten bei Formycon
One Team – One Purpose
Bei Formycon arbeiten Menschen aus mehr als 30 Nationen gemeinsam an einem Ziel: Weltweit Patienten und Patientinnen den Zugang zu lebenswichtigen Therapien zu ermöglichen. Lernen Sie unser Unternehmen und das #TeamFormycon kennen!
Wir sind #TeamFormycon!
Bei uns ist jede und jeder Einzelne mehr als nur ein Mitarbeitender – bei uns sind Sie Teil eines Teams, das zusammen an einem wichtigen Ziel arbeitet: hochwirksame und bezahlbare Biosimilars für alle.
Kultur der vertrauensvollen Zusammenarbeit
Rund 250 engagierte Mitarbeitende aus mehr als 30 Nationen arbeiten im #TeamFormycon – davon rund 60 % Frauen und 40 % Männer. Über 80 % unserer Kolleginnen und Kollegen sind in der Forschung und Entwicklung tätig. Unsere Unternehmenskultur basiert auf Vertrauen, Transparenz und Verantwortung. Wir leben flache Hierarchien, offenen Austausch und gegenseitige Wertschätzung – vom Labor bis zur Vorstandsebene. Bei Formycon zählt Teamgeist mehr als Titel.
Wissenschaft mit Wirkung
Wir konzentrieren uns auf die Entwicklung hochwertiger Biosimilars. Bei uns verbinden sich Forschung und Sinnhaftigkeit zu einem klaren Ziel: weltweit den Zugang zu lebenswichtigen Therapien zu verbessern. Ihre Arbeit hat direkten Einfluss auf die Gesundheit vieler Menschen.
Nachhaltigkeit & Verantwortung
Wir übernehmen Verantwortung – gegenüber unseren Mitarbeitenden, der Gesellschaft und der Umwelt. Durch nachhaltige Prozesse reduzieren wir unseren ökologischen Fußabdruck, fördern soziale Gerechtigkeit und setzen auf verantwortungsvolle Unternehmensführung. Nachhaltigkeit ist für uns ein integraler Bestandteil unseres Selbstverständnisses als führender Biosimilar-Entwickler.
Flexibles Arbeiten & moderne Benefits
Hybrides Arbeiten, moderne Büros und Labore, betriebliche Gesundheitsförderung und weitere attraktive Benefits sorgen dafür, dass Sie Beruf und Privatleben gut vereinbaren können. Ihre Arbeit ist wertvoll – erfahren Sie, was Sie von uns erwarten können

Unsere Unternehmensbereiche
Bei Formycon finden Sie spannende Bereiche, in denen Sie Ihre Expertise einbringen und einen wichtigen Beitrag leisten können – einen, der weit über den eigenen Bereich hinaus wirkt. Erfahren Sie, wie Sie bei uns einen Unterschied machen können.
Research & Development
Hier schlägt unser wissenschaftliches Herz
In R&D treffen Forschung, Produktentwicklung sowie klinische und regulatorische Expertise aufeinander. Gemeinsam arbeiten unsere Teams daran, neue Biosimilars zu entwickeln und zur Marktreife zu bringen – effizient, lösungsorientiert und mit dem guten Gefühl, Leben zu verbessern.
Business Development
Den Markt im Blick, die Zukunft im Fokus
Ob Licensing, Supply Chain & Logistic, Procurement oder IP – unser Business Development ist vielfältig aufgestellt. Hier treiben wir strategische Partnerschaften voran, bereiten die Kommerzialisierung vor und schaffen die Basis für nachhaltiges Wachstum.
Enabling Functions
Wir geben Struktur, damit Ideen wachsen können
IT, Legal & Compliance, Finance & Controlling, HR, IR & Corp.Communications, Facility Management – unsere Enabling Functions sorgen dafür, dass alles rundläuft. Hier schaffen und sichern wir die Strukturen, die es uns ermöglichen, fokussiert und effizient als gesamtes #TeamFormycon an unseren Zielen zu arbeiten.
Exzellenz ist kein Ziel – sie ist unsere Haltung. Jeden Tag.
Exzellenz bedeutet für uns Verantwortung zu übernehmen – für unsere Arbeit, unser Handeln und die Wirkung, die wir mit unseren Medikamenten in der Welt erzielen. In einer Branche, in dem Vertrauen und erstklassige Wissenschaft entscheidend sind, stehen Verbindlichkeit und Transparenz im Zentrum unseres Handelns. Was uns täglich motiviert? Der Sinn unserer Arbeit – wir wissen, dass wir durch unser Tun Leben verändern.
Neugier ist der Antrieb unserer Innovationen.
Wir glauben an Wissenschaft, die weiterdenkt. Unsere Offenheit für neue Wege, kreative Ideen und echte Begeisterung für eine zukunftsorientierte Wissenschaft treiben uns an. Wir fördern eine Kultur, in der Wissen geteilt wird, Lernen selbstverständlich ist – und Verbesserung kein Ziel, sondern ein fortlaufender Prozess ist. Denn wer neugierig bleibt, bleibt in Bewegung.
Vielfalt macht uns stärker.
Unser internationales und diverses #TeamFormycon ist der Motor für unseren Erfolg. Menschen mit unterschiedlichen Perspektiven, Erfahrungen und Hintergründen sehen wir als Bereicherung. Wir leben eine Kultur, die Vielfalt nicht nur unterstützt, sondern aktiv fördert.
Bei uns steht der Mensch im Mittelpunkt – immer.
Wir begegnen einander mit Respekt, Vertrauen und echter Wertschätzung. Unsere gelebte Open-Door-Kultur steht für einen offenen Austausch auf Augenhöhe – wir hören zu, teilen Verantwortung und unterstützen uns gegenseitig. Wir sind überzeugt, dass dieses Miteinander der Nährboden für große Ideen und nachhaltige Erfolge ist.
Neugierig geworden?
Entdecken Sie unsere aktuellen Stellenangebote und werden Sie Teil von #TeamFormycon. Wir freuen uns darauf, Sie kennenzulernen – als Mensch, als Talent, als Mitgestalter:in.
Karriere__N1
Karriere
Change Life for the Better
Wir bei Formycon arbeiten daran, den Zugang zu hochmodernen und erschwinglichen Arzneimitteln weltweit zu verbessern. Was uns als Team verbindet? Ein starkes Wir-Gefühl, die Begeisterung für zukunftsweisende Medizin und die Überzeugung, den Unterschied zu machen.
Gemeinsam Gesundheit gestalten – wissenschaftlich stark, menschlich verbunden. Werden auch Sie Teil von #TeamFormycon.

Wir sind Formycon. Bei uns treffen Begeisterung für Medizin und den Menschen auf eine starke Unternehmenskultur. Wir kombinieren wissenschaftliche Exzellenz mit gesellschaftlicher Verantwortung. Als führendes, konzernunabhängiges Unternehmen in der Entwicklung hochwertiger Biosimilars bieten wir nicht nur innovative Lösungen für die Gesundheitsversorgung von morgen – wir schaffen auch ein Arbeitsumfeld, in dem Ihre Ideen zählen, Ihr Beitrag Wirkung zeigt und Ihre Entwicklung im Fokus steht.
Erfahren Sie mehr ...
Depotdaten aktualisieren
Anleihe 2025
Depotdaten aktualisieren
Bitte lesen Sie zunächst den Haftungsausschluss durch!
Die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen sind weder an Personen gerichtet, die sich in den Vereinigten Staaten von Amerika (“Vereinigte Staaten” oder “U.S.”), Kanada, Australien oder Japan oder einer Rechtsordnung, in welcher eine Verteilung oder Veröffentlichung rechtswidrig wäre, befinden, noch für deren Zugriff bestimmt. Diese Unterlagen und Informationen begründen oder bilden weder in den Vereinigten Staaten, Australien, Kanada oder Japan oder einer anderen Rechtsordnung, in welcher ein solches Angebot oder eine solche Werbung nicht gestattet sind, noch gegenüber einer Person, der gegenüber es rechtswidrig ist, ein solches Angebot abzugeben oder eine solche Aufforderung zu schalten, einen Teil eines Angebots oder eine Aufforderung dazu, Wertpapiere zu erwerben oder zu zeichnen.
Insbesondere handelt es sich bei den Informationen auf den folgenden Webseiten nicht um ein Angebot zum Verkauf von Wertpapieren in den Vereinigten Staaten. Die hier erwähnten Wertpapiere wurden nicht und werden nicht gemäß dem U.S. Securities Act von 1933, in der gültigen Fassung (“Securities Act”), registriert werden und dürfen in den Vereinigten Staaten außer im Rahmen der Ausnahmetatbestände von den Registrierungsanforderungen des Securities Act nicht angeboten oder verkauft werden. In den Vereinigten Staaten wird es für die Wertpapiere kein öffentliches Angebot geben.
Für Nutzer, die sich im Vereinigten Königreich befinden
Auf die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen dürfen im Vereinigten Königreich nur solche Personen zugreifen, die “qualifizierte Anleger” im Sinne von Artikel 2(e) der Verordnung (EU) 2017/1129 des Europäischen Parlaments und des Rates vom 14. Juni 2017 in der jeweils gültigen Fassung (“Prospektverordnung”) sind, die aufgrund des European Union (Withdrawal) Act 2018 Teil des nationalen Rechts des Vereinigten Königreichs ist, und die außerdem (i) professionelle Anleger, die unter Artikel 19(5) der Financial Services and Markets Act 2000 (Financial Promotion) Order 2005 in der jeweils gültigen Fassung (“Erlass”) fallen, oder (ii) vermögende Unternehmen und andere Personen, denen sie rechtmäßig mitgeteilt werden können und die unter Artikel 49 Absatz 2 Buchstaben a) bis d) des Erlasses fallen (alle diese Personen werden zusammen als “relevante Personen” bezeichnet). Die Wertpapiere stehen nur relevanten Personen zur Verfügung, und jede Aufforderung, jedes Angebot oder jede Vereinbarung, diese Wertpapiere zu zeichnen, zu kaufen oder anderweitig zu erwerben, wird nur mit relevanten Personen getroffen. Jede Person, die keine relevante Person ist, sollte nicht auf der Grundlage dieser Unterlagen oder dieser Informationen oder ihres Inhalts handeln oder sich darauf verlassen.
Für Nutzer, die sich im Europäischen Wirtschaftsraum befinden
Auf die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen dürfen nur Personen zugreifen, die sich in einem Mitgliedstaat des Europäischen Wirtschaftsraums (“EWR”) (ausgenommen Deutschland und Luxemburg) befinden oder dort ansässig sind und “qualifizierte Anleger” im Sinne von Artikel 2(e) der Prospektverordnung sind. Falls Sie als Treuhänder oder Vertreter für eines oder mehrere Anlegerkonten handeln, (a) ist jedes dieser Konten ein qualifizierter Anleger, (b) verfügen Sie über eine Verwaltungsvollmacht für Anlagen für jedes dieser Konten und (c) verfügen Sie über eine uneingeschränkte Befugnis und Ermächtigung, die in dieser Bestätigung enthaltenen Zusicherungen, Verpflichtungen und Anerkenntnisse für jedes dieser Konten abzugeben.
In bestimmten Rechtsordnungen kann es rechtswidrig sein, die Unterlagen und Informationen einzusehen, die Sie im Begriff sind abzurufen. In anderen Rechtsordnungen ist es möglicherweise nur bestimmten Personengruppen gestattet, solche Unterlagen einzusehen. Jede Person, die bestrebt ist, diese Unterlagen einzusehen, hat sich zunächst zu vergewissern, dass sie nicht ortsbedingten Anforderungen unterfällt, die ihr dies verbieten oder insofern einschränken.
Sollte es Ihnen nicht erlaubt sein, die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen einzusehen oder bestehen in Ansehung Ihrer Berechtigung insofern irgendwelche Zweifel, verlassen Sie bitte diese Webseite.
Grundlage des Zugangs
Der Zugang zu digitalisierten Ausfertigungen der auf den folgenden Webseiten enthaltenen Unterlagen und Informationen wird von der Formycon AG (“Gesellschaft”) in gutem Glauben und ausschließlich zu Informationszwecken angeboten. Der Umstand, dass diese Unterlagen und Informationen in digitalisierter Form auf den folgenden Webseiten zugänglich gemacht werden, stellt kein Angebot und keine Aufforderung dar, ein Angebot gerichtet auf den Erwerb von Wertpapieren der Gesellschaft abzugeben. Des Weiteren begründet dies keine Empfehlung der Gesellschaft oder eines Dritten, Wertpapiere der Gesellschaft zu kaufen oder zu verkaufen. Sie stimmen zu, dass die Unterlagen, die Sie erhalten, für Ihren eigenen Gebrauch sind und dass Sie diese nicht an andere Personen verteilen werden.
Bestätigung des Verständnisses und der Annahme des Haftungsausschlusses
Mit Drücken der Schaltfläche “Weiter”
- versichern Sie, dass Sie sich nicht in den Vereinigten Staaten, Kanada, Australien oder Japan oder einer Rechtsordnung, in welcher der Vertrieb oder die Veröffentlichung rechtswidrig wäre, befinden;
- versichern Sie, sofern Sie sich im Vereinigten Königreich befinden, dass Sie eine “relevante Person” (wie oben definiert) sind; und
- versichern Sie, sofern Sie sich im EWR (ausgenommen Deutschland und Luxemburg) befinden, dass Sie ein “qualifizierter Anleger” (wie oben definiert) sind.
Ich habe den vorstehenden Haftungsausschluss gelesen und verstanden. Mir ist bewusst, dass er meine Rechtsposition beeinflussen kann. Ich erkläre mich mit dessen Bedingungen einverstanden. Indem ich den „Weiter“-Button drücke, bestätige ich, dass ich zu den digitalisierten Fassungen dieser Unterlagen voranschreiten darf.
Kontakt
Formycon AG
Disclaimer_Exit
Disclaimer
Vielen Dank für Ihr Interesse!
Wir freuen uns sehr über Ihr Interesse an der Formycon AG. Aus rechtlichen Gründen können wir Ihnen leider keinen Zugang zu den nachfolgenden Informationen gewähren, da Sie nicht bestätigt haben, dass (I) Sie diese Mitteilung und die Beschränkungen vollständig gelesen haben und akzeptieren, (II) dass Sie Ihren Wohnsitz in Deutschland oder Luxemburg haben und (III) dass Sie sich damit einverstanden erklären, die auf den folgenden Webseiten enthaltenen Informationen nicht an Personen zu verteilen, weiterzuleiten oder anderweitig zur Verfügung zu stellen, die ihren Wohnsitz nicht in Deutschland oder Luxemburg haben oder dort ansässig sind. Vielen Dank für Ihr Verständnis.
Disclaimer
Disclaimer
Haftungsausschluss – Wichtig!
Die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen sind weder an Personen gerichtet, die sich in den Vereinigten Staaten von Amerika (“Vereinigte Staaten” oder “U.S.”), Kanada, Australien oder Japan oder einer Rechtsordnung, in welcher eine Verteilung oder Veröffentlichung rechtswidrig wäre, befinden, noch für deren Zugriff bestimmt. Diese Unterlagen und Informationen begründen oder bilden weder in den Vereinigten Staaten, Australien, Kanada oder Japan oder einer anderen Rechtsordnung, in welcher ein solches Angebot oder eine solche Werbung nicht gestattet sind, noch gegenüber einer Person, der gegenüber es rechtswidrig ist, ein solches Angebot abzugeben oder eine solche Aufforderung zu schalten, einen Teil eines Angebots oder eine Aufforderung dazu, Wertpapiere zu erwerben oder zu zeichnen.
Insbesondere handelt es sich bei den Informationen auf den folgenden Webseiten nicht um ein Angebot zum Verkauf von Wertpapieren in den Vereinigten Staaten. Die hier erwähnten Wertpapiere wurden nicht und werden nicht gemäß dem U.S. Securities Act von 1933, in der gültigen Fassung (“Securities Act”), registriert werden und dürfen in den Vereinigten Staaten außer im Rahmen der Ausnahmetatbestände von den Registrierungsanforderungen des Securities Act nicht angeboten oder verkauft werden. In den Vereinigten Staaten wird es für die Wertpapiere kein öffentliches Angebot geben.
Für Nutzer, die sich im Vereinigten Königreich befinden
Auf die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen dürfen im Vereinigten Königreich nur solche Personen zugreifen, die “qualifizierte Anleger” im Sinne von Artikel 2(e) der Verordnung (EU) 2017/1129 des Europäischen Parlaments und des Rates vom 14. Juni 2017 in der jeweils gültigen Fassung (“Prospektverordnung”) sind, die aufgrund des European Union (Withdrawal) Act 2018 Teil des nationalen Rechts des Vereinigten Königreichs ist, und die außerdem (i) professionelle Anleger, die unter Artikel 19(5) der Financial Services and Markets Act 2000 (Financial Promotion) Order 2005 in der jeweils gültigen Fassung (“Erlass”) fallen, oder (ii) vermögende Unternehmen und andere Personen, denen sie rechtmäßig mitgeteilt werden können und die unter Artikel 49 Absatz 2 Buchstaben a) bis d) des Erlasses fallen (alle diese Personen werden zusammen als “relevante Personen” bezeichnet). Die Wertpapiere stehen nur relevanten Personen zur Verfügung, und jede Aufforderung, jedes Angebot oder jede Vereinbarung, diese Wertpapiere zu zeichnen, zu kaufen oder anderweitig zu erwerben, wird nur mit relevanten Personen getroffen. Jede Person, die keine relevante Person ist, sollte nicht auf der Grundlage dieser Unterlagen oder dieser Informationen oder ihres Inhalts handeln oder sich darauf verlassen.
Für Nutzer, die sich im Europäischen Wirtschaftsraum befinden
Auf die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen dürfen nur Personen zugreifen, die sich in einem Mitgliedstaat des Europäischen Wirtschaftsraums (“EWR”) (ausgenommen Deutschland, Luxemburg und Österreich) befinden oder dort ansässig sind und “qualifizierte Anleger” im Sinne von Artikel 2(e) der Prospektverordnung sind. Falls Sie als Treuhänder oder Vertreter für eines oder mehrere Anlegerkonten handeln, (a) ist jedes dieser Konten ein qualifizierter Anleger, (b) verfügen Sie über eine Verwaltungsvollmacht für Anlagen für jedes dieser Konten und (c) verfügen Sie über eine uneingeschränkte Befugnis und Ermächtigung, die in dieser Bestätigung enthaltenen Zusicherungen, Verpflichtungen und Anerkenntnisse für jedes dieser Konten abzugeben.
In bestimmten Rechtsordnungen kann es rechtswidrig sein, die Unterlagen und Informationen einzusehen, die Sie im Begriff sind abzurufen. In anderen Rechtsordnungen ist es möglicherweise nur bestimmten Personengruppen gestattet, solche Unterlagen einzusehen. Jede Person, die bestrebt ist, diese Unterlagen einzusehen, hat sich zunächst zu vergewissern, dass sie nicht ortsbedingten Anforderungen unterfällt, die ihr dies verbieten oder insofern einschränken.
Sollte es Ihnen nicht erlaubt sein, die auf den folgenden Webseiten enthaltenen Unterlagen und Informationen einzusehen oder bestehen in Ansehung Ihrer Berechtigung insofern irgendwelche Zweifel, verlassen Sie bitte diese Webseite.
Grundlage des Zugangs
Der Zugang zu digitalisierten Ausfertigungen der auf den folgenden Webseiten enthaltenen Unterlagen und Informationen wird von der Formycon AG (“Gesellschaft”) in gutem Glauben und ausschließlich zu Informationszwecken angeboten. Der Umstand, dass diese Unterlagen und Informationen in digitalisierter Form auf den folgenden Webseiten zugänglich gemacht werden, stellt kein Angebot und keine Aufforderung dar, ein Angebot gerichtet auf den Erwerb von Wertpapieren der Gesellschaft abzugeben. Des Weiteren begründet dies keine Empfehlung der Gesellschaft oder eines Dritten, Wertpapiere der Gesellschaft zu kaufen oder zu verkaufen. Sie stimmen zu, dass die Unterlagen, die Sie erhalten, für Ihren eigenen Gebrauch sind und dass Sie diese nicht an andere Personen verteilen werden.
Bestätigung des Verständnisses und der Annahme des Haftungsausschlusses
Mit Drücken der Schaltfläche “Weiter”
- versichern Sie, dass Sie sich nicht in den Vereinigten Staaten, Kanada, Australien oder Japan oder einer Rechtsordnung, in welcher der Vertrieb oder die Veröffentlichung rechtswidrig wäre, befinden;
- versichern Sie, sofern Sie sich im Vereinigten Königreich befinden, dass Sie eine “relevante Person” (wie oben definiert) sind; und
- versichern Sie, sofern Sie sich im EWR (ausgenommen Deutschland, Luxemburg und Österreich) befinden, dass Sie ein “qualifizierter Anleger” (wie oben definiert) sind.
Ich habe den vorstehenden Haftungsausschluss gelesen und verstanden. Mir ist bewusst, dass er meine Rechtsposition beeinflussen kann. Ich erkläre mich mit dessen Bedingungen einverstanden. Indem ich den „Weiter“-Button drücke, bestätige ich, dass ich zu den digitalisierten Fassungen dieser Unterlagen voranschreiten darf.
Test 2025
Test 2025
Hier steht eine Headline zum
Projekt Test
Hier steht ein Introtext: Lorem ipsum dolor sit amet, consectetur adipiscing elit. Phasellus auctor hendrerit sagittis. Nulla viverra malesuada nisi, quis sodales diam rutrum congue. Nunc rutrum eleifend nisl.
Eckdaten des Test
| Rechtsform | Aktiengesellschaft |
| Erstnotiz | 20. Dezember 2010 |
| ISIN | DE000A1EWVY8 |
| WKN | A1EWVY |
| Börsensegment | Regulierter Markt (Prime Standard) |
| Handelsplätze | Xetra, Berlin, Düsseldorf, Frankfurt, Hamburg, München, Stuttgart, Tradegate |
| Aktiengattung | Stückaktien o.N. |
| Grundkapital | 17.672.927,00 Euro |
| Anzahl der Aktien | 17.672.927 Stückaktien |
| Designated Sponsors | Oddo BHF Corporates |
Testmöglichkeiten
Lorem ipsum dolor sit amet, consetetur sadipscing elitr, sed diam nonumy eirmod tempor invidunt ut labore et dolore magna aliquyam erat, sed diam voluptua. At vero eos et accusam et justo duo dolores et ea rebum. Stet clita kasd gubergren, no sea takimata sanctus est Lorem ipsum dolor sit amet. Lorem ipsum dolor sit amet, consetetur sadipscing elitr, sed diam nonumy eirmod tempor invidunt ut labore et dolore magna aliquyam erat, sed diam voluptua. At vero eos et accusam et justo duo dolores et ea rebum. Stet clita kasd gubergren, no sea takimata sanctus est Lorem ipsum dolor sit amet.
Digitale Zeichnung
FAQ
In drei bis fünf Jahren sehen wir Formycon mit mindestens drei bzw. vier via Kommerzialisierungspartnern international vertriebenen Biosimilar-Produkten im Markt. Darüber hinaus wird unsere Produktpipeline weiter gereift und erweitert sein. Das Unternehmen ist zu einem international renommierten Biosimilar-Player avanciert und gründet auf soliden Finanzzahlen.
Im Gegensatz zu Generika, die durch eine chemische Synthese hergestellt werden und den absolut identischen Wirkstoff wie das ehemals patentgeschützte Präparat enthalten, werden Biosimilars mit Hilfe lebender Organismen produziert. Dies erfolgt meist in Zellkulturen wie beispielsweise in Bakterien, Hefezellen oder Säugetierzellen.1 Aus diesem Grund dauert eine Biosimilar-Entwicklung zwischen 7 und 10 Jahre2 (versus 2 bis 3 Jahre bei Generika3) und erfordert ein Budget zwischen 150 und 300 Mio. Euro3 (versus 5 bis 10 Mio. €3 bei einem Generikum).
Quellen:
1 Was sind eigentlich Biosimilars?
2 IQVIA Assessing the Biosimilar Void.
3 Schätzung des Unternehmens; Entwicklungszeiten und -kosten sind
je nach Indikation und Wirkstoffgruppe sehr unterschiedlich.
Unsere wichtigsten Assets sind unsere Pipelineprojekte, denn sie schaffen Werte. Daher wird unser Fokus auch weiterhin auf dem Ausbau der Plattform liegen. Wir planen derzeit alle 12 bis 18 Monate einen neuen Biosimilar-Kandidaten zu starten.
Wir evaluieren Kandidaten unabhängig von ihrem Indikationsgebiet. Der Schlüssel zu einer nachhaltigen und wertgenerierenden Plattform ist unserer Ansicht nach ein smarter Mix aus Nischen- und Blockbuster-Produkten bei der Auswahl der richtigen Kandidaten.
Die Wahrscheinlichkeit, dass ein Biosimilar erfolgreich zugelassen wird liegt bei etwa 95%, wenn man seine Hausaufgaben exakt und sorgfältig über die gesamte Entwicklungsdauer hinweg gemacht hat. Entscheidender Inflection Point ist der sogenannte Technical Proof of Similarity (TPOS). Ab hier steigt die Wahrscheinlichkeit einer erfolgreichen Zulassung von Phase zu Phase.
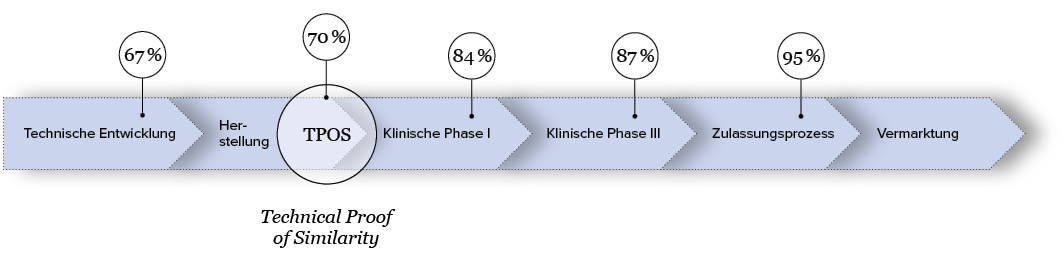
Quelle: The path towards a tailored clinical biosimilar development, Schiestl et. al 2020
Formycon setzt bisher KI-Tools ein, um interne Prozesse zu beschleunigen und effizienter zu gestalten. Auch bei der Produktentwicklung kann KI eingesetzt werden, insbesondere bei der effizienten Auswahl von Hilfsstoffen in der Formulierungsentwicklung und Optimierung der Stabilität von Formulierungen. Ebenso nutzen wir KI, um bessere Prognosen aus unseren Daten erhalten zu können. KI wird in Zukunft sicher eine noch größere Rolle in der Diagnostik spielen, sowohl im Rahmen von klinischen Studien als auch in der klinischen Praxis.
Im Vergleich zu großen Pharmaunternehmen sind wir in der Lage wie ein agiles Schnellboot zu agieren und uns den aktuellen Gegebenheiten schnell und wendig anzupassen. Das Besondere im Biosimilar-Bereich ist, dass Mitbewerber immer auch potenzielle Partner sein können. Was Formycon auszeichnet, sind die ausschließlich auf Biosimilars fokussierten Expert:innen, die bereits sehr viele Jahre Erfahrung in der Entwicklung und Zulassung von Biosimilars gesammelt haben und sämtliche Chancen und Herausforderungen entlang der Wertschöpfungskette bestens kennen. Hinzu kommt, dass es weit über 200 biologische Wirkstoffe gibt und kein Unternehmen all diese Wirkstoffe selbstständig entwickeln kann, auch die großen Pharmakonzerne nicht. Daher werden wir auch für diese stets ein attraktiver Partner sein.
Die Entwicklung dieser Arzneimittelklasse spricht klar für einen weiteren Uptake und eine weitere Etablierung von Biosimilars. Das zeigen die Einsparungen, die Biosimilars in den letzten Jahren erzielt haben. Im Global Use of Medicines Report von IQVIA wird prognostiziert, dass Biosimilars bis zum Jahr 2027 weltweit Einsparungen in Höhe von 290 Mrd. US-Dollar generieren werden. Diese Kosteneinsparungen eröffnen den Gesundheitssystemen an anderen Stellen wiederum mehr finanziellen Spielraum, weshalb sie einen wichtigen Beitrag zu einer nachhaltigen Gesundheitsversorgung leisten.
FYB201 wird unter dem Handelsnamen Ongavia® in Großbritannien, Ranopto® in Kanada und Ranivisio® in Europa sowie weiteren Ländern von Teva Pharmaceuticals Ltd. vertrieben. In den USA wird Cimerli® von Sandoz vermarktet und in der MENA-Region durch MS Pharma unter den Handelsnamen Uptera® und Ravegza®.
Für FYB202/Otulfi® wird unser Kommerzialisierungspartner für die globalen Schlüsselmärkte Fresenius Kabi sein.
Für FYB203 und weitere Biosimilar-Kandidaten wurden noch keine Kommerzialisierungspartnerschaften veröffentlicht.
Wir sehen uns als R&D Powerhouse mit einer voll skalierbaren Biosimilar-Entwicklungsplattform und fühlen uns in dieser Rolle sehr wohl. Dennoch ist Formycon auf Wachstum ausgerichtet, um sich als globaler Player im Bereich der Biosimilars zu etablieren. Hierzu gehört grundsätzlich auch die Prüfung von Opportunitäten anorganischen Wachstums entlang der Wertschöpfungskette.
Formycon ist ein auf Wachstum ausgerichtetes Unternehmen mit aktuell einem Produkt im Markt. Demnach ist es im Sinne einer nachhaltigen und wertschöpfenden Unternehmensentwicklung wahrscheinlich, dass wir die Rückflüsse in bestehende und neue Entwicklungsprojekte re-investieren werden und vorerst nicht planen, eine Dividende auszuschütten.
Kontakt
Formycon AG
Investor Relations Hotline: 089 864 667 112
E-Mail: ir@formycon.com