FYB202
Ustekinumab-Biosimilar
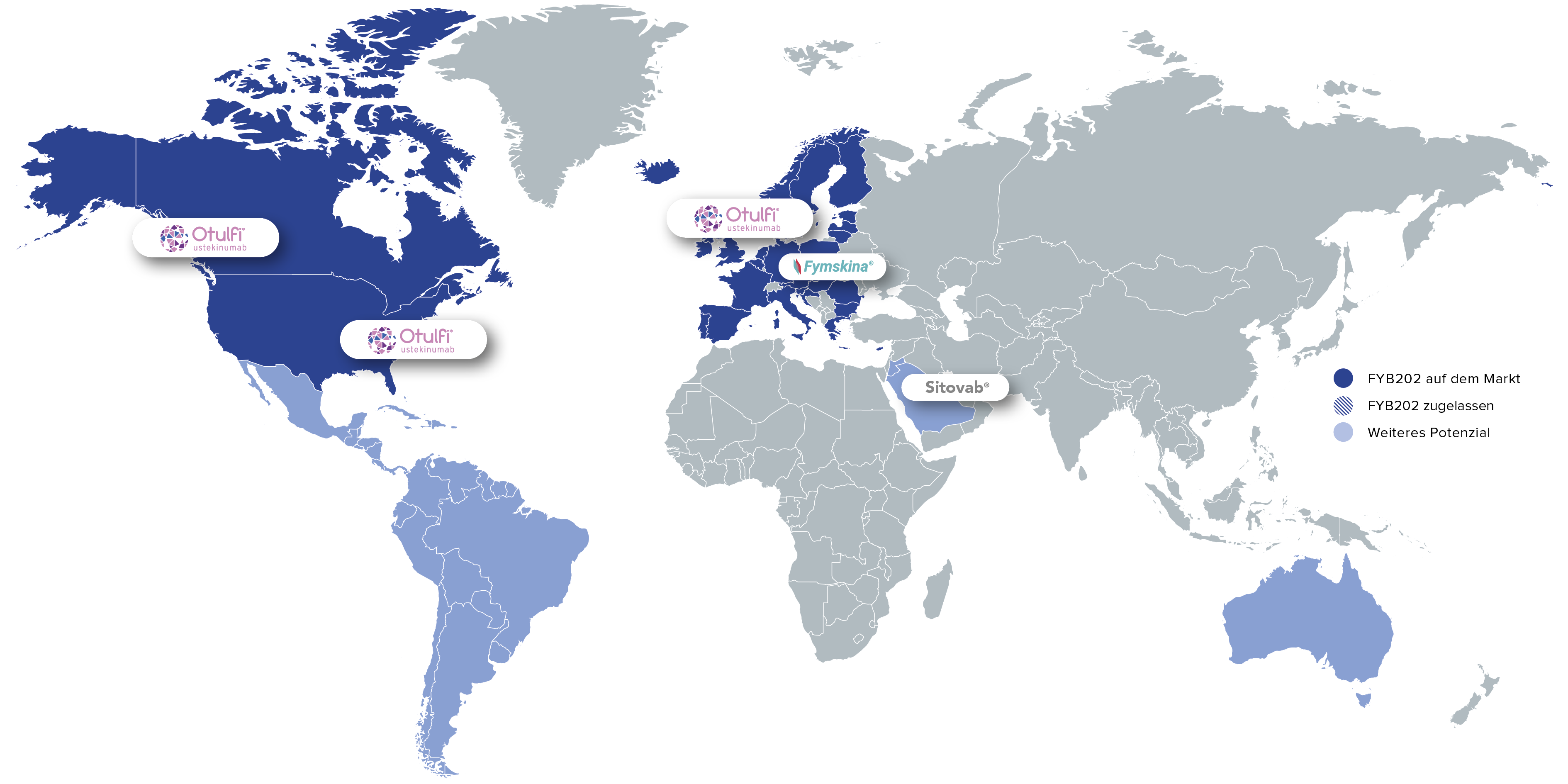
FYB202 ist als Behandlungsoption für Patientinnen und Patienten mit chronisch-entzündlichen Erkrankungen in den USA, Europa und Kanada auf dem Markt. Weitere Produkteinführungen – unter anderem in der MENA-Region – sind geplant.
Indikationsgebiet
Immunologie
Wirkstoffgruppe
Immunsuppressiva /
Interleukin-Inhibitoren
Indikationen des Referenzarzneimittels*
Morbus Crohn, Colitis Ulcerosa, Plaque-Psoriasis (Schuppenflechte), psoriatische Arthritis
Markteintritt
ab Q1/2025
Ustekinumab-Markt
Der weltweite Umsatz mit dem Referenzarzneimittel Stelara® lag im Jahr 2024 bei rund 10,4 Mrd. US$. Die mögliche Verwendung von Uste-kinumab für weitere therapeutische Indikationen bietet zusätzliches Umsatzpotenzial.
Kommerzialisierungspartner:
![]()
Brand: Otulfi®
Region: Globale Schlüsselmärkte
![]()
Brand: Fymskina®
Region: Deutschland
![]()
Brand: Sitovab®
Region: MENA
sind in der Produktinformation der EMA oder FDA zu entnehmen.

FYB202 Biosimilar-Entwicklung

FYB202 Biosimilar-Entwicklung
So wirkt FYB202 (Ustekinumab)
Bei Ustekinumab handelt es sich um einen humanen monoklonalen Antikörper, der gegen die Zytokine Interleukin-12 und Interleukin-23 gerichtet ist und zur Behandlung verschiedener schwerwiegender inflammatorischer Erkrankungen wie mittelschwerer bis schwerer Psoriasis (Schuppenflechte) eingesetzt wird. 2016 erfolgte eine Indikationserweiterung für die Behandlung von Morbus Crohn und 2019 für die Behandlung von Colitis Ulcerosa, beides chronisch-entzündliche Darmerkrankungen. Darüber hinaus wird das Präparat auch bei psoriatischer Arthritis eingesetzt.
Juni 2025
![]()
Teva-Tochter Ratiopharm wird Zweitvermarktungspartner für FYB202/Fymskina® in Deutschland
Mai 2025
![]()
Markteinführung von FYB202/Otulfi® in Kanada
[Weitere Informationen]
März 2025
![]()
Markteinführung von FYB202/Otulfi® in den USA und der EU
[Weitere Informationen]
Januar 2025
![]()
Zulassung in Großbritannien
[Weitere Informationen]
Januar 2025
![]()
Zulassung in Kanada
[Weitere Informationen]
Dezember 2024
![]()
MS Pharma wird Kommerzialisierungspartner für die MENA-Region
[Weitere Informationen]
September 2024
![]()
FYB202 Zulassung in den USA
[Weitere Informationen]
September 2024
![]()
FYB202 Zulassung in der EU
[Weitere Informationen]
Juli 2024
![]()
Positive CHMP-Empfehlung für die Marktzulassung in der EU
[Weitere Informationen]
März 2024
![]()
Settlement-Vereinbarung mit Johnson & Johnson für Europa und Kanada
[Weitere Informationen]
November 2023
![]()
Annahme des Zulassungsantrags durch die U.S. Food and Drug Administration (FDA)
[Weitere Informationen]
September 2023
![]()
Annahme des Zulassungsantrags durch die europäische Arzneimittelagentur EMA
[Weitere Informationen]
August 2023
![]()
Settlement-Vereinbarung mit Johnson & Johnson für FYB202 in den USA
[Weitere Informationen]
April 2023
![]()
Abschluss der klinischen Entwicklung von FYB202
[Weitere Informationen]
Februar 2023
![]()
Abschluss einer globalen Kommerzialisierungspartnerschaft mit Fresenius Kabi
[Weitere Informationen]
August 2022
![]()
Positives Zwischenergebnis der Phase-III-Studie
[Weitere Informationen]
März 2022
![]()
Formycon übernimmt die vollständigen Rechte an FYB202 im Rahmen einer Transaktion mit der ATHOS KG
[Weitere Informationen]
November 2020
![]()
Start der klinischen Phase-III-Studie
[Weitere Informationen]
Oktober 2019
![]()
Start der klinischen Phase-I-Studie
[Weitere Informationen]
Dezember 2017
![]()
Formycon und Aristo Pharma gründen Joint-Venture für die Entwicklung von FYB202
[Weitere Informationen]
Mai 2017
![]()
Veröffentlichung des Moleküls
[Weitere Informationen]
Präklinische und klinische Daten
Daten zur Vergleichbarkeit des Biosimilars FYB202 mit dem Referenzarzneimittel wurden im Rahmen mehrerer Posterpräsentationen sowie in einem Fachartikel veröffentlicht.
Otulfi® ist eine eingetragene Marke von Fresenius Kabi Deutschland GmbH in ausgewählten Ländern



