FYB203
Aflibercept-Biosimilar
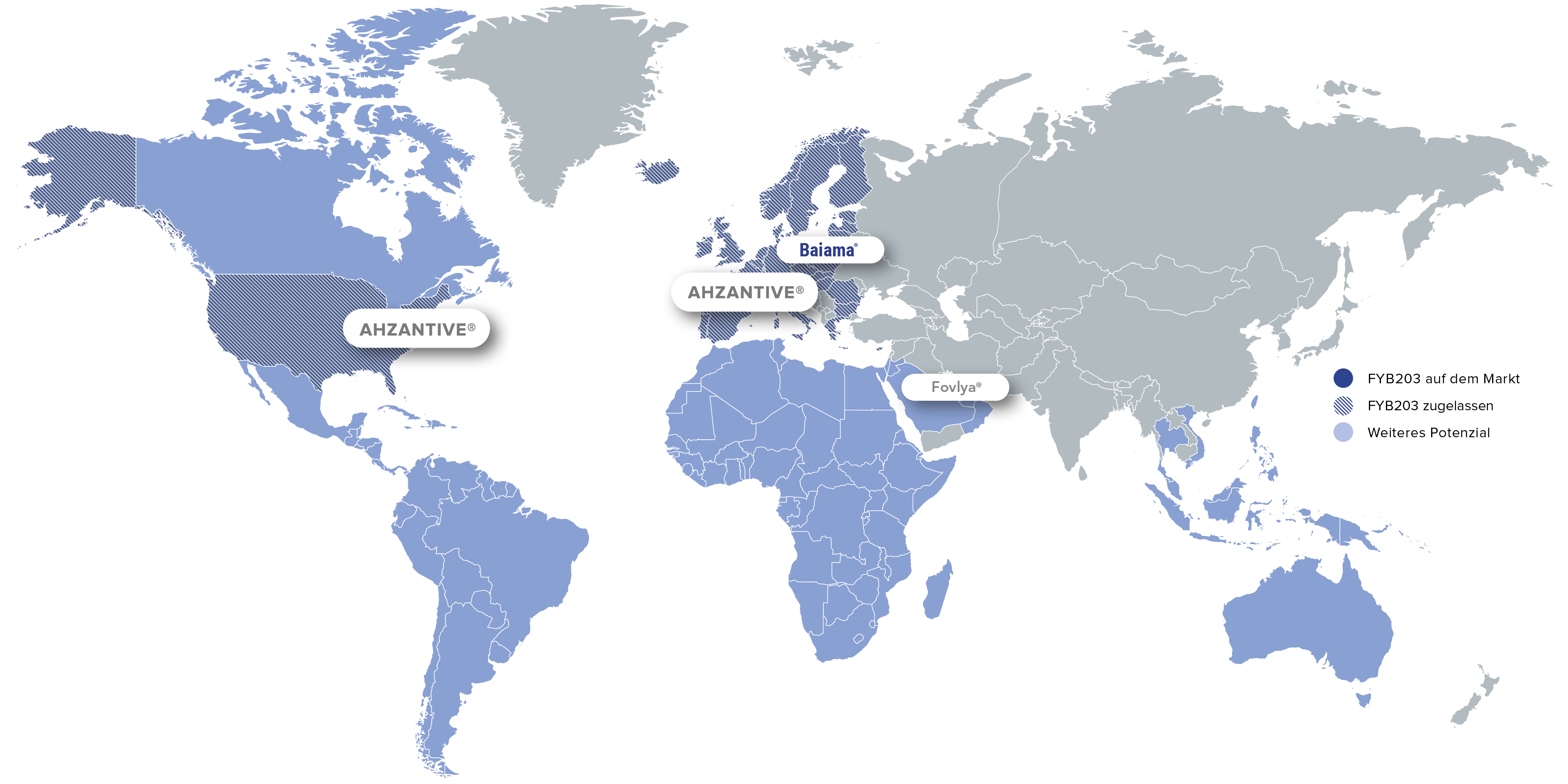
FYB203 ist in den USA und in Europa zur Behandlung schwerer Netzhauterkrankungen wie der neovaskulären (feuchten) altersbedingten Makuladegeneration zugelassen. Die Markteinführung in den USA ist im 4. Quartal 2026 geplant.
Indikationsgebiet
Ophthalmologie
Wirkstoffgruppe
VEGF-Inhibitor
Indikationen des Referenzarzneimittels
Neovaskuläre (feuchte) altersbedingte Makuladegeneration, Diabetisches Makulaödem, Choroidale Neovaskularisation, Proliferative diabetische Retinopathie, Makulaödem infolge eines Netzhautvenenverschlusses*
Markteintritt
in den USA in Q4/2026 sowie in weiteren Regionen nach Ablauf der Exklusivität des Referenzarzneimittels
Aflibercept-Markt
Aflibercept und Ranibizumab machen zusammen mehr als 90 % des Weltmarktes für Anti-VEGF-Therapien aus. Im Jahr 2024 erwirtschaftete das Referenzarzneimittel Eylea® in den Dosierungen 2mg und 8mg (High-Dose) zusammen einen Umsatz von rund 9,5 Mrd. US$.
Kommerzialisierungspartner:
![]()
Brand: Ahzantive®
Region: Weite Teile Europas
![]()
Brand: Baiama®
Region: Ausgewählte EU-Länder
![]()
Brand: Ahzantive®
Region: US, Kanada
![]()
Brand: Baiama®
Region: Italien
![]()
Brand: Fovlya®
Region: MENA
![]()
Brand: N.N.
Region: Lateinamerika
![]()
Brand: N.N.
Region: APAC
![]()
Brand: N.N.
Region: Australien
sind in der Produktinformation der EMA oder FDA zu entnehmen.

FYB203 Biosimilar-Entwicklung

FYB203 Biosimilar-Entwicklung
So wirkt FYB203 (Aflibercept)
Bei Aflibercept handelt es sich um ein humanes, rekombinantes Fusionsprotein, das neben dem vaskulären endothelialen Wachstumsfaktor (VEGF-A) auch an den plazentaren Wachstumsfaktor (PLGF) bindet. Damit unterdrückt Aflibercept die Entstehung von Blutgefäßen in der Netzhaut, die die Sehfähigkeit verschlechtern. Ebenso wie Ranibizumab wird Aflibercept direkt in den Glaskörper des Auges injiziert.
Aufgrund der unterschiedlichen Wirkmechanismen ergänzen sich Aflibercept und Ranibizumab in der Praxis sehr gut. Manche Patienten sprechen besser auf Aflibercept, andere besser auf Ranibizumab an. Mit unseren Biosimilars soll der Zugang zu qualitativ hochwertigen und kosteneffizienteren Behandlungsmöglichkeiten für Ärzte und Patienten im Bereich der Augenheilkunde verbessert werden.
November 2025
![]()
NTC wird Kommerzialisierungspartner für Italien
[Weitere Informationen]
Oktober 2025
![]()
Kommerzialisierungspartnerschaften für Australien und Lateinamerika mit Actor und Megalabs
[Weitere Informationen]
Oktober 2025
![]()
Settlement-Vereinbarung mit Regeneron sichert US-Vermarktungsstart in Q4/2026
[Weitere Informationen]
September 2025
![]()
Horus Pharma wird Zweitvermarktungspartner für ausgewählte EU-Länder
[Weitere Informationen]
Juni 2025
![]()
US-Biosimilarspezialist Valorum Biologics wird Kommerzialisierungspartner für die USA und Kanada
[Weitere Informationen]
Februar 2025
![]()
FYB203 Zulassung in Großbritannien
[Weitere Informationen]
Februar 2025
![]()
Lotus Pharmaceutical wird Kommerzialisierungspartner für die Region Asien/Pazifik
[Weitere Informationen]
Januar 2025
![]()
FYB203 erhält EU-Zulassung durch die Europäische Kommission
[Weitere Informationen]
Januar 2025
![]()
Teva wird Kommerzialisierungspartner für FYB203 in weiten Teilen Europas und Israel
[Weitere Informationen]
November 2024
![]()
FYB203 erhält positive CHMP-Empfehlung für die Marktzulassung in der EU
[Weitere Informationen]
Juli 2024
![]()
US-Zulassung von FYB203 durch die FDA
[Weitere Informationen]
Mai 2024
![]()
MS Pharma wird Kommerzialisierungspartner für FYB203 in der MENA-Region
[Weitere Informationen]
Dezember 2023
![]()
Annahme des Zulassungsantrags für FYB203 durch die EMA
[Weitere Informationen]
November 2023
![]()
Einreichung des Zulassungsantrags für FYB203 bei der EMA
[Weitere Informationen]
August 2023
![]()
Annahme des Zulassungsantrags für FYB203 durch die FDA
[Weitere Informationen]
Juni 2023
![]()
Einreichen des Zulassungsantrags für FYB203 bei der FDA
[Weitere Informationen]
Februar 2023
![]()
Vergleichbare Wirksamkeit zum Referenzarzneimittel in Phase-III-Studie nachgewiesen
[Weitere Informationen]
August 2020
![]()
Start der klinischen Entwicklung von FYB203
[Weitere Informationen]
Februar 2016
![]()
Formycon veröffentlicht Details zum Biosimilar-Kandidaten FYB203
[Weitere Informationen]
Mai 2015
![]()
Auslizenzierung von FYB203 an die Santo Holding GmbH
[Weitere Informationen]
Ahzantive® ist eine eingetragene Marke von Klinge Biopharma GmbH


