Blog
Enno Spillner interviewed at the Equity Forum in Frankfurt
(in German only)
At the Equity Forum in Frankfurt on November 24, CFO Enno Spillner spoke with Börsen Radio Network AG about Formycon’s current Q3 results. He emphasized that the company remains confident that it will become profitable by 2027.
At the same time, he emphasized that Formycon remains committed to its mission: to reduce healthcare costs and give patients access to affordable therapies.
Tune in and enjoy the full interview!
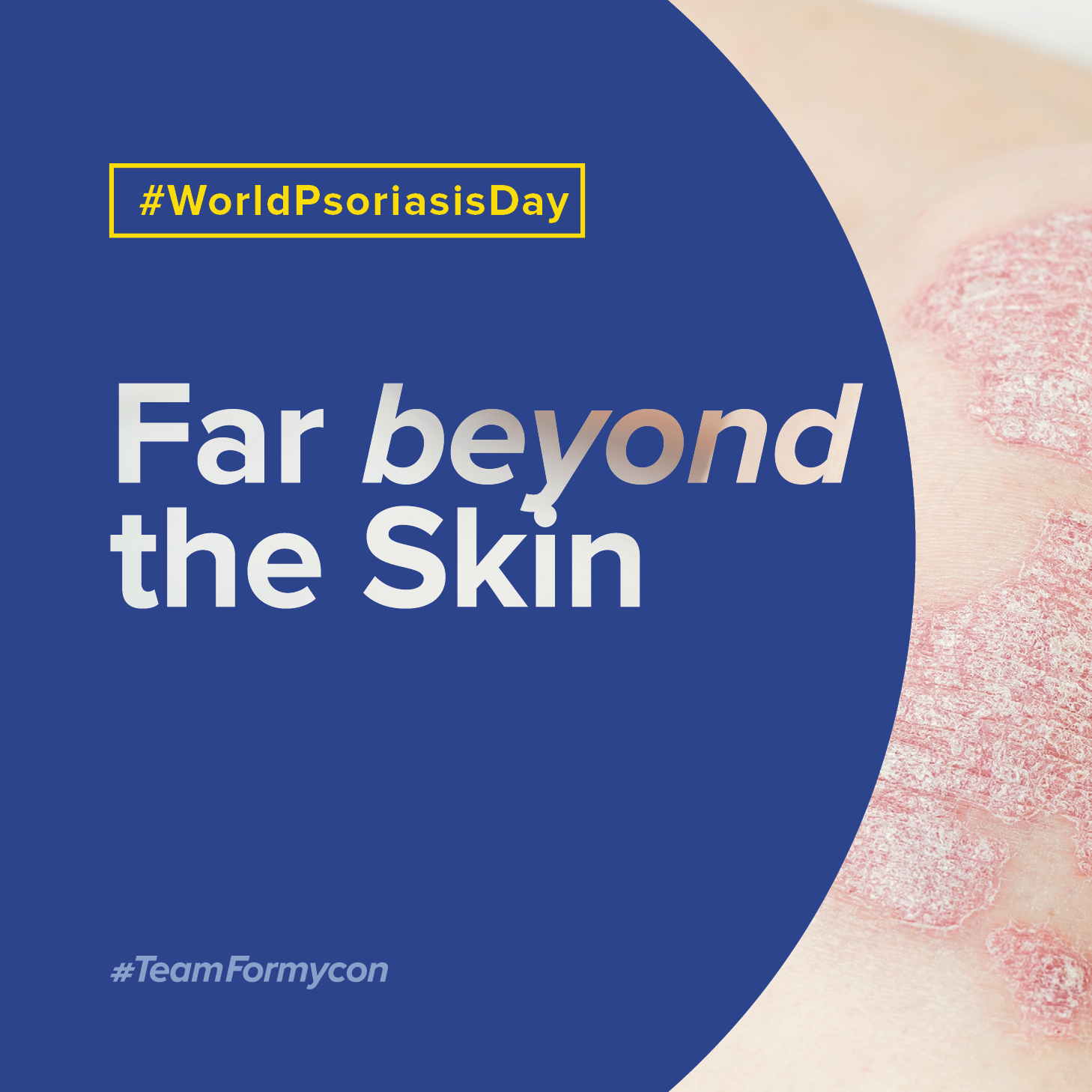
Psoriatic Disease and Comorbidities – Early diagnosis and proper treatment save lives
Psoriasis is more than just a skin condition. It is a complex, incurable systemic immune disease that is associated with psychosocial impairments, high levels of suffering and often one or more comorbidities.
One inflammation leads to the next
The inflammatory processes usually affect more than just the skin. There is often a domino effect with far-reaching consequences for the whole body. The most common comorbidities of psoriasis include joint inflammation (arthritis), cardiovascular disease, type 2 diabetes mellitus and depression. The risk of being affected by a comorbidity increases with the severity of the psoriasis.
Early treatment can stop the wave
With modern therapies, psoriasis can be well controlled in the vast majority of patients. However, drug therapies, e.g. with interleukin inhibitors, are often very expensive and not accessible to all of the approximately 60 million people affected worldwide. Biosimilars can help to close these gaps in treatment by making established active ingredients available in high quality and at a lower cost.
Formycon, as a pure-play biosimilar developer, is committed to the mission of improving access to such modern therapy options worldwide. In the case of psoriasis, specifically with the ustekinumab biosimilar FYB202.
Find out more about World Posriasis Day at: https://www.ifpa-pso.com/global-actions-overview/world-psoriasis-day
Preserving vision – Anti-VEGF therapies for severe retinopathies

👁️ On World Sight Day, we we are turning our attention to retinopathies, in other words: diseases of the retina that can be responsible for severe visual impairment and even blindness. While age-related macular degeneration – as the name suggests –mainly affects the elderly, diabetic retinopathies are the most common cause of blindness in people of working age. Around 540 million people worldwide live with diabetes – and the number is constantly rising. One of the most serious consequences is the development of a diabetic retinopathy. Around one in three people with diabetes develops some form of this retinal damage during the course of their condition.
💡 What does this mean for those affected?
Retinopathies often go unnoticed at first, but if left untreated, they can lead to severe vision loss. For patients, this is often associated with major impairments, loss of quality of life and stress at work and in their personal environment.
👁️🗨️ Treatment options
If detected early, the chances of successful treatment are now better than ever – for example, with anti-VEGF therapies. They stop the pathological formation of new blood vessels in the retina and can significantly slow down the progression of the disease. However, these often very expensive treatments are not yet available to all patients.
🎯 Improving access to anti-VEGF therapies
Formycon has made it its mission to improve access to such therapies worldwide. With Formycon’s ranibizumab biosimilar FYB201, an effective and cost-effective treatment option is already available in many countries. A further Formycon biosimilar product will complement the treatment spectrum: FYB203/aflibercept has already been approved in several regions and is waiting in the wings, so to speak. Together, the two agents cover a significant share of anti-VEGF therapies.
Learn more about Formycon’s biosimilars here.
#TeamFormycon #Biosimilars #Ophthalmology #VEGF #nAMD #DR #DME
Enno Interviewed by Börsen Radio Network AG at the Hamburg Investor Days
(in German only)
During his participation at the 14th Hamburg Investor Days on August 28, our CFO Enno Spillner was interviewed by Börsen Radio Network AG.
In the interview, he discussed the broader biosimilar market as well as Formycon’s business model. The conversation also touched on financing strategies and Formycon’s recently placed bond.
Tune in and enjoy the full interview!
"The biosimilar market is growing with incredible momentum"
Interview with 4investors (in German only)

Enno Spillner
Chief Financial Officer (CFO)
Formycon AG
In an interview with 4investors, Enno Spillner, CFO of Formycon AG, talks about the rapidly growing biosimilar market, Formycon’s 2025/2029 bond, and how the proceeds will fuel Formycon’s further growth.
You can read the full interview here:
Formycon: „Biosimilar-Markt wächst mit beeindruckender Dynamik“ | 4investors
"Unlocking more economic potential through the bond."
Interview with BONDGUIDE (in German only)

Enno Spillner
Chief Financial Officer (CFO)
Formycon AG
In an interview with BONDGUIDE, Enno Spillner, CFO of Formycon AG, discusses Formycon’s debut corporate bond, which creates new financial flexibility to unlock the full potential of the biosimilar pipeline.
You can read the full interview here:
Formycon: „Mithilfe der Anleihe mehr ökonomisches Potential ausschöpfen“ – BondGuide
Formycon at the mwb Research Roundtable
June 13, 2025
With numerous approvals, new commercialization partnerships, and product launches in various regions of the world, Formycon achieved important milestones in the first half of the year and consistently advanced its corporate development. We expect further significant operational and commercial progress in the coming months.
Although structural challenges regarding access to biosimilars continue to exist in specific markets, the global biosimilar business continues to grow dynamically and offers tremendous potential: for better patient care worldwide, for relieving the burden on healthcare systems, and for a company highly specialized in biosimilars such as Formycon.
You are currently viewing a placeholder content from YouTube. To access the actual content, click the button below. Please note that doing so will share data with third-party providers.
More InformationAt the mwb Research Roundtable, Dr. Stefan Glombitza (CEO), Enno Spillner (CFO), and Dr. Andreas Seidl (CSO) discuss these developments and answer participants’ questions. The Roundtable is in German.
„Biosimilar prices in the US are already at European level“
Interview with goingpublic (in German only)

Dr. Stefan Glombitza
Chief Executive Officer (CEO)
Formycon AG
In an interview with goingpublic, Dr. Stefan Glombitza, Chief Executive Officer of Formycon AG, talks about Formycon`s future strategy for product commercialization and the market environment for biosimilars in the US.
The complete interview can be read here:
„Biosimilarpreise in den USA sind bereits auf europäischem Niveau“ | GoingPublic.de
Strategic Partnerships as a central Success Factor in Biotechnology
Gastbeitrag im German Biotech Report 2025
(in englischer Sprache)
Strategic partnerships between biotech companies and large pharma players have become a cornerstone of innovation and market access. Biotech companies like Formycon, which specialize in biosimilars (biological medicines that are highly similar to already-approved medicines), rely on these alliances to efficiently bring their products to market. For instance, through partnerships with Fresenius Kabi, Sandoz and Teva, Formycon has successfully advanced the commercialization of several biosimilars. These collaborations underscore a broader industry trend: success in biotech is driven not only by scientific innovation but also by the ability to forge strong alliances that enable commercial access and scalability as well as mitigating financial risks. In an industry where regulatory approval processes and market access are highly complex, partnershipsbbetween small biotech firms and large pharma companies are essential for long-term sustainable growth.
EMA outlines tailored clinical approach for the development of biosimilars
April 02, 2025

“Biosimilars may be approved without providing CES (Comparative Clinical Efficacy Studies) or even PD data (Pharmacodynamic) if similar clinical efficacy and safety pharmacology can be inferred from a sufficiently stringent evaluation of analytical comparability, in vitro pharmacology, and a comparative clinical PK (Pharmacokinetic) trial”, is the conclusion of the “Reflection paper on a tailored clinical approach in biosimilar development” the EMA has just released for public consultation.
We at Formycon clearly welcome this approach, as it has the potential to accelerate biosimilar development and reduce costs significantly. In the long term, this could also reduce the often-described biosimilar void (the number of off-patent biologics without biosimilar competition) and improve patient access to biologic therapies. With regard to our decision to discontinue the Phase III trial of our biosimilar candidate FYB206 we see the reflection paper as confirmation. We believe that the EMA’s considerations support our approach of demonstrating the therapeutic comparability of FYB206 with the reference drug Keytruda® based on comprehensive analytical data and the data from the Phase I study (Dahlia PK study).
According to the EMA draft, in terms of clinical development, PK studies (Phase-I-Studies) are in general sufficient for the approval of a biosimilar. CES studies (Phase-III-Studies) may still be required in cases where a “biological is not well-characterisable and/or has an unknown or poorly understood Mode of Action, structure-function relationship, or if the impact of observed differences on clinical outcomes is unclear”. To address any remaining uncertainty regarding comparability in exposure, safety and immunogenicity, the comparative PK study will be adapted in the reflected tailored clinical approach.
The published draft can be reviewed and commented on during the public consultation period until the end of September 2025: https://www.ema.europa.eu/en/documents/other/reflection-paper-tailored-clinical-approach-biosimilar-development_en.pdf